本文是中医论文,3.天香丹可能通过激活Nrf2/ARE信号通路,促进下游抗氧化因子NQO1、CAT、HO-1表达(P<0.05),清除体内自由基,减轻氧化应激损伤,改善冠脉微循环障碍。综上所述,本研究中采用左心室内注射月桂酸钠建立大鼠冠脉微循环障碍模型,天香丹给药治疗后,通过实验探究治疗前后大鼠心功能,心肌病理学及超微结构的改变。在此基础上,研究天香丹对氧化应激相关因子的改变情况,并基于Nrf2/ARE信号通路探讨可能的作用机制。通过以上研究为探明天香丹改善冠脉微循环障碍的作用机制提供客观有力的证据,为其临床应用提供理论依据和实验基础。线粒体膜较其它生物膜含有更多的不饱和脂肪酸,对脂质过氧化更敏感。过量产生的ROS会损害线粒体的膜结构,影响线粒体膜两侧的质子梯度,引起脂质过氧化,膜通透性增加,电子传递链活性的进一步下降,形成恶性循环,最终造成线粒体破裂。细胞发生氧化应激反应时,在电镜下可观察到线粒体肿胀、嵴排列紊乱、数量减少甚至消失,造成细胞功能进一步紊乱[53]。研究发现心肌梗死、缺血再灌注损伤、动脉粥样硬化等心血管疾病都会产生大量的ROS,机体的抗氧化应激系统短时间内难以清除全部ROS,导致大量ROS残留于血液中,形成内皮细胞氧化应激状态。内皮细胞氧化损伤时,细胞膜发生脂质过氧化,溶酶体释放大量酸性物质,细胞质内的线粒体、内质网等细胞器结构出现破坏、溶解,细胞内核酸及蛋白质变性。
.............
.............
前言
月桂酸钠具有强烈的血管内皮损伤作用,以往常被用于复制外周动脉的血管栓塞模型,以研究抗血小板及抗血栓类药物的疗效及机制。有经心尖部向SD大鼠左心室内注射月桂酸钠,从而建立微循环障碍动物模型的报道[14]。研究发现月桂酸钠作为血管内皮损伤的诱发物,可造成微血管内皮细胞的脱落、穿孔,增多凝血因子进而诱发血小板黏附、聚集,促进微血栓的形成[15,16]。因此,使用月桂酸钠作为内皮损伤剂进行冠脉内注射制作冠脉微循环障碍模型.更贴近临床病理生理的实际情况[17]。故本研究中采用月桂酸钠化学损伤法建立大鼠冠脉微循环障碍动物模型。冠脉微循环障碍可归为中医“胸痹心痛病”。中医学里大、中、小血管多为经脉,而微动脉、微静脉可归属于络脉,冠脉微循环则可视作心之络脉。气血、脏腑、经络功能障碍可致心络瘀阻、血行不畅,甚至形成微小癥积(血栓),与冠脉微循环障碍时心肌的完整性受损及灌注不足相似。因此,中医治疗冠脉微循环障碍多以益气、活血、化瘀、通络为治则。天香丹是根据已故名医张绚邦教授提出的治疗胸痹心痛的通补开泄法为理论研发的治疗冠心病的院内制剂。其补气活血,芳香开泄,临床应用30余年来已取得良好的效果。研究表明天香丹能够从临床症状上改善冠心病患者的胸闷胸痛、心悸等;可通过降低vWF、TpP、FIB减少血栓形成;通过调控NF-κB和p38MAPK信号通路,抑制炎症因子IL-1β和TNF-α表达,控制炎症反应[18];并调节血浆ET、NO,保护血管内皮,减轻自由基损伤,保护微循环,改善心肌缺血症状[19,20]。
.........
.........
研究内容与方法
1实验材料
SPF级雄性SD大鼠63只,体质量18020g,购于新疆医科大学动物实验中心,动物许可证号:SYXK(新)2016-007,饲养于新疆医科大学动物实验中心SPF级环境中。本动物实验通过新疆医科大学动物伦理委员会批准,编号:IACUC-20170222027。关闭胸腔时使用注射器抽出胸腔内空气,防止气胸。逐层缝合肌肉、皮下组织和皮肤,认真观察大鼠状态,待自主呼吸稳定后方可拔除气管插管,大鼠呼吸不畅时可以重新给予呼吸支持。术前严格选择健康个体进行实验,以保证模型制备成功。左心室内注射月桂酸钠或生理盐水时采用操作熟练的一人进行,避免因操作失误给大鼠造成伤害。术中或术后出现心脏骤停或者呼吸停止,给予胸外心脏按压,并使用加热垫保持大鼠体温恒定,待大鼠完全苏醒后送回鼠笼饲养。手术全程无菌操作,术后连续3d给予青霉素80万U腹腔注射预防感染。大鼠腹腔注射1%戊巴比妥钠(40mg/kg),待全身麻醉后,仰卧固定于45°手术板上,四肢使用胶带固定。手术区域备皮后消毒,用冷光源照射大鼠颈部,大鼠颈部皮肤较薄,可看到口腔内部结构。将大鼠舌部牵出口腔,清晰地看到声门随着呼吸开合,趁大鼠吸气的瞬间迅速地将气管插管插入气道,将备好的棉线置于管口,棉线若随着管口进出的气流而摆动,即可证实插管插在气道,确定后用一次性医用胶布固定住气管插管。使用一次性1mLBD胰岛素针刺入左心室(以有回血为准),迅速注入月桂酸钠1ml/kg(浓度2mg/mL)[23],同时夹闭升主动脉与主动脉弓连接处10s,使注入的月桂酸钠顺利进入冠状动脉。
中医论文格式
2实验方法
本研究中参考文献[21]选用雄性SD大鼠制作冠脉微循环障碍动物模型。将63只SPF级雄性SD大鼠,适应性喂养一周后,在大鼠尾部使用记号笔随机编写1-63号,使用SPSS软件随机分组法随机分为:空白对照组、假手术组、模型组、尼可地尔组、天香丹低剂量组、天香丹中剂量组、天香丹高剂量组,每组9只大鼠。每周重新标记大鼠尾部数字,以防编号丢失。各组大鼠饲养于新疆医科大学动物实验中心SPF级环境中,普通饲料喂养,自由饮水饮食,不限制活动。按照体表面积法,大鼠给药剂量g/(kg·d)=成人每日剂量(g)×大鼠体重与体表面积比值/人体重与体表面积比值,天香丹低剂量组大鼠给予0.4704(kg)2/3g/d天香丹颗粒灌胃;天香丹中剂量组大鼠给予0.9408(kg)2/3g/d天香丹颗粒灌胃;天香丹高剂量组大鼠给予1.8816(kg)2/3g/d天香丹颗粒灌胃;尼可地尔组给予尼可地尔每日0.7840(kg)2/3mg/d尼可地尔溶入生理盐水中灌胃;空白对照组、模型组给予每日灌胃生理盐水,每只大鼠给药体积均为2mL/d。每日给药1次,每周按体重调整给药量,共给药28天。模型组、天香丹低剂量组、天香丹中剂量组、天香丹高剂量组、尼可地尔组大鼠采用左心室注射月桂酸钠法建立冠脉微循环障碍动物模型,假手术组为注射生理盐水。之后使用棉球压迫止血,待心率稳定后逐层缝合,关闭胸腔。一些学者将尼可地尔用于PCI的围手术期,结果表明尼可地尔在改善冠脉微循环,降低无复流/慢血流的发生率、患者的梗塞面积,和保护心肌缺血方面作用显著[36,37]。
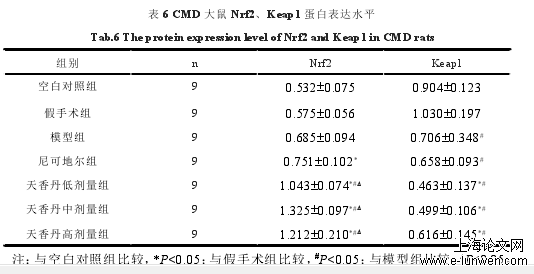
CMD大鼠Nrf2、Keap1蛋白表达水平
研究内容与方法.......................................................20
结果..............................................................................25
讨论........................................................................................30
讨论........................................................................................30
小结..........................................................................................38
讨论
1冠脉微循环障碍动物模型的建立
由于临床研究受到伦理学等方面的限制,成功制作冠脉微循环障碍动物模型可以为其发病机制及病理生理研究提供可靠的研究平台。冠状动脉微循环障碍动物模型制备尚无统一的标准,目前主要有介入造模及开胸手术两种方式制备微循环障碍动物模型。介入造模通过导管向犬、猪或绵羊冠脉左前降支或回旋支注射栓塞剂,以建立CMD动物模型[29,30]。虽具有创伤小、动物存活率高等优点,但因操作复杂,所需动物价格昂贵等原因,未被普遍采用。开胸手术为最常用的造模方式,常采用左心室或主动脉内注射自体血栓、自体脂肪或月桂酸钠等进行造模[31-33],按机制又可分为机械阻塞法和化学损伤法。自体血栓等栓塞剂无法模拟临床中冠脉微循环发生时血管内皮损伤等病变,仅通过机械阻塞达到损伤冠脉微循环的目的。月桂酸钠能够造成微血管内皮损伤导致其脱落、穿孔,进而诱发血小板黏附、聚集,促进微血栓的形成。因此,使用月桂酸钠作为内皮损伤剂进行冠脉内注射制作冠脉微循环障碍模型更贴近临床病理生理的实际情况。故本研究中采用左心室注射月桂酸钠建立冠脉微循环障碍动物模型。钙通道阻滞剂如维拉帕米及地尔硫䓬等已显示可降低微血管张力并缓解痉挛,从而有可能改善CMD患者的冠脉血流储备[35]。本研究中选用尼可地尔作为阳性对照药。尼可地尔具有双重作用机制,除了有类硝酸酯效应,还具有独特的ATP敏感的K+通道开放作用。前者直接舒张冠脉,后者通过激活ATP敏感性K+通道稳定线粒体内膜和阻止解偶联,增加细胞膜对K+的通透性,抑制Ca2+流入,能够舒张不同直径的冠脉,显著扩张微小冠脉,减轻前、后负荷,增加冠脉血流。尼可地尔被认为是冠脉微血管心绞痛治疗的首选药物[1]。
2氧化应激导致冠脉微循环障碍CMD的病理机制
目前尚无统一,但众多研究显示冠脉微循环障碍系多因素、多机制共同影响所致,包括微血管病变、血管内皮功能障碍、炎症反应、氧化应激、血液流变性异常等,均参与了冠脉微循环病理过程的发生发展[38,39]。心肌缺血缺氧时会损害血管内皮,导致嗜中性粒细胞和血小板的粘附,引起管腔狭窄或闭塞,进一步加重微循环障碍。在心肌再灌注时钙超载,氧自由基生成增加,炎性细胞浸润和凋亡信号通路的激活,这些变化加重了局部缺血并形成恶性循环[40]。线粒体利用氧气生成能量的过程中,会产生活性氧自由基(reactiveoxygenspecies,ROS)。正常状态下,机体氧化与抗氧化系统处于相对稳定的状态,体内的抗氧化因子可通过抗氧化酶保护细胞免受氧化损伤并清除自由基[41,42]。体内过多的氧自由基能够改变心肌细胞膜和亚细胞膜的通透性和流动性,影响细胞的完整性和功能[43-45]。当心肌灌注不足时,伴随大量ROS产生和堆积,而引发机体内源性氧化应激[46]。其机制包括:(1)心肌细胞缺血缺氧时细胞内氧分压降低,ATP生成减少,Ca2+进入线粒体增多,线粒体氧化磷酸化功能障碍,细胞色素氧化酶系统功能失调,电子传递链受损,以致进入细胞内的氧经单电子还原而形成的ROS增多[47,48]。(2)缺血缺氧时中性粒细胞在辅酶II(NADPH)的作用下产生ROS,称之为“呼吸爆发”,起着消灭病原体和组织损伤的双重作用。当氧自由基生成过多、或机体清除自由基的酶系统活性不足时,就会进一步损害细胞[49]。(3)心肌缺血缺氧时ATP生成减少,细胞内Ca2+增多,增强Ca2+依赖性蛋白酶活性,加速黄嘌呤脱氢酶转化为黄嘌呤氧化酶,促进自由基生成[50]。
........
小结
内皮细胞逐渐剥落脱离血管,造成内皮下的胶原纤维逐渐裸露,内源性凝血体系被激活后,由内源性凝血体系刺激受损伤内膜释放组织因子,激活外源性凝血体系,受损伤内膜变粗糙后血小板聚集,粘附于裸露的胶原纤维上。当血管内皮功能不全时,内皮源性NO生物利用度降低,血管壁炎性反应增强,促凝物质增多,粘附因子增加,白细胞黏附,血小板及单核-巨噬细胞活化、聚集,最终促使血栓的形成。前列环素(PGI2)有抗血小板和舒张血管作用,它的合成减少可促进血栓形成。ROS可抑制PGI2合成酶活性,同时促进致聚剂血栓烷A2(TXA2)的表达,使PGI2/TXA2比值下降,导致血小板聚集。过氧化使脂质增加,导致红细胞和血浆蛋白交联而使血黏度升高,形成微血栓。ROS可以刺激NF-κB信号通路,诱导炎性因子如TNF-α,IL-1β,IL-6的表达[54]。它们可以直接刺激血管内皮细胞,从而导致血管内皮细胞受损并增加其通透性,导致凝血酶和肾上腺素诱导并释放血小板活化因子(Platelet-activating-factor,PAF),PAF促进血小板活化,聚集,粘附并最终形成血栓[55]。因此,氧化应激会促进炎症反应和血栓形成[56-58]。在缺血缺氧条件下交感-肾上腺髓质系统被激活,释放和分泌大量儿茶酚胺,一方面可代偿调节缺氧所致的心功能下降,另一方面过多的儿茶酚胺在单胺氧化酶的催化作用下,自氧化生成氧自由基[51]。氧自由基能够特异性结合不饱和共价键,因此,生物膜磷脂中的不饱和脂肪酸最容易受到氧自由基的攻击。在H2O2引起的氧化应激中可见细胞膜完整性遭到破坏[52]。
参考文献(略)

