本文是一篇硕士论文,硕士论文是攻读硕士学位研究生所撰写的论文。它应能反映出作者广泛而深入地掌握专业基础知识,具有独立进行科研的能力,对所研究的题目有新的独立见解,论文具有一定的深度和较好的科学价值,对本专业学术水平的提高有积极作用。(以上内容来自百度百科)今天为大家推荐一篇硕士论文,供大家参考。
第一章 胺类化合物的不对称氧化 α-C–H 键官能团化反应研究进展
1.1 前言
C–H 键氧化官能团化是选择性构筑 C–C 和 C-杂键的有效的方法1,2。在过去的十多年里,关于这种直接的 C–H 键偶联策略的应用已经有一系列的报道。在有机合成中,两个 C–H 键或者杂-H 键的直接交叉偶联(CDC)可以说是一种高效,经济,并且相对清洁的方法来构筑 C–C 和 C-杂键3。在这些反应中,胺类化合物的 α-C(sp3)–H 氧化偶联,特别是三级胺的氧化偶联,已经取得了很大的研究进展4。然而,将这种直接的 C–H 键偶联的策略发展成一般常用的选择性催化方法仍然面临巨大的挑战,因为许多的亲核试剂在当量的氧化剂下并不能稳定存在,譬如氧气(O2)、过氧化氢(H2O2)、苯醌(BQ)、醋酸碘苯(PhIO(Ac)2)、叔丁基过氧化氢(TBHP)、2,3-二氯-5,6-二氰基-1,4-苯醌(DDQ)、过氧单磺酸钾(Oxone)、2-碘酰基苯甲酸(IBX)等。最近几年,许多科研小组在不对称氧化偶联方面取得了巨大进展,在这一章,我们主要对胺类化合物的选择性氧化α-C(sp3)–H 官能团化构筑 C–C 和 C-杂键的研究进展进行系统性的概述。
..........
1.2 过渡金属催化的不对称氧化 α-C–H 键官能团化反应
四氢异喹啉(THIQ)衍生物是许多具有生物活性的药物分子及天然产物的重要组成骨架5。由于四氢异喹啉生物碱一号位的碳手性中心的药物和生物活性6,发展一种可以由简单原料直接来合成此类化合物的方法就显得尤为重要。2004 年,Li 课题组首次报道了 N-芳基四氢异喹啉与炔烃的不对称氧化偶联反应7。反应以 10 mol% 的 CuOTf 为催化剂,15 mol% 的 Pybox L1 为手性配体,1.0 当量的 TBHP 为氧化剂,四氢呋喃为溶剂,50oC 反应 48h 可以以中等产量的收率和对映选择性得到炔基化的四氢异喹啉衍生物 (图 1-1)。在该反应中,相比于脂肪族炔烃,芳基炔烃可以得到较高的产率和对映选择性。实验同时表明芳环上的 4-甲氧基(R1)对对映选择性没有影响,而 2-甲氧基的存在则可以提高其对性选择性达到 74% ee 值。对映选择性提高的原因可能是芳环 2 号位上的取代基的位阻作用,也有可能是 2-甲氧基上的氧原子与铜的配位作用。
.......
第二章 手性磷酸催化不对称氧化偶联反应合成 α-氨基磷酸酯的研究
2.1 引言
近年来,手性 α-氨基磷酸酯由于其具有抗艾滋病1,抗菌2及作为酶抑制剂3或者磷酯抑制剂4等生物活性而在现代药物化学中受到广泛关注 (图2-1,A)。由于手性磷酸酯的生物活性依赖于 α-碳原子的绝对构型,所以发展一种直接有效的方法来合成手性 α-氨基磷酸酯就显得尤为重要。纵观手性 α-氨基磷酸酯的合成方法发展的历程,最直接的方法就是磷酸酯对亚胺化合物的不对称加成反应,即 aza-Pudovik 反应5-7。另一种常用的方法是不对称 Kabachnik-Fields 反应,即磷酸酯,胺类化合物与羰基化合物的不对称三组分反应8。除此之外,还有过渡金属催化的亚胺的不对称氢化反应9与相转移催化剂催化的不对称反应10。但是由于亚胺及醛类的稳定性较差,所以以上方法就有了一定的局限性。2004年,Li 课题组首次成功地报道了通过不对称氧化偶联的方法来合成手性胺化合物11。受此鼓励,许多课题组尝试用此种方法来合成手性 α-氨基磷酸酯化合物12,令人遗憾的是,尽管他们以较高的产率得到了产物,但是并没有实现其不对称化。在此,我们首次通过手性磷酸催化的不对称氧化偶联反应来合成不饱和手性 α-氨基磷酸酯 (图 2-1,B)。
...........
2.2 结果与讨论
刚开始探究手性磷酸催化的不对称磷酰化反应的时候,我们以 4-溴-N-肉桂基苯胺 2a (1.0 equiv) 与亚磷酸二异丙酯 (2.0 equiv) 为底物,碳酸银 (1.1 equiv)为氧化剂,手性磷酸 1a (10 mol%) 为催化剂,氩气氛围下于 50oC 反应 72h,幸运的是我们以 27%的收率和 42% ee 值得到了目标产物 (图 2-2)。受到该结果的鼓励,我们合成了一系列的不同取代基团的手性磷酸来催化该反应 (图 2-2,1b-1s)。当我们以 1b 取代 1a 作为催化剂的时候,我们可以得到更高的对映选择性。这也表明手性磷酸的不同的取代基骨架对反应的对应选择性有很大的影响。接下来,我们我们检验了手性磷酸 3,3’-位置上的不同取代基的影响 (图 2-2,1c-1e),当 4-MeC6H4, 4-CF3C6H4, 4-ClC6H4在手性磷酸的 3,3’-位置上,对映选择性有少许的提升,并且吸电子基团 4-CF3C6H4, 4-ClC6H4相对于给电子基团4-MeC6H4得到较高的产率和对映选择性。当将取代基换为2-PhC6H4, 2-FC6H4,2-acetyl-C6H4(图 2-2, 1f-1h) 时,仍旧没有得到令人满意的结果。随后多取代基3,5-CF3C6H3,3,5-MeC6H3和 3,4-MeC6H3(图 2-2, 1i-1k) 也用于该反应,但是最好的结果也只有49%的产率和62% ee。当将取代基换为五氟苯 (图2-2, 1l) 时,我们可以得到 82% ee 的目标产物,虽然产率只有 21%。我们也检验了较大的取代基,譬如三苯基硅 (图 2-2, 1m),2,4,6-三异丙基苯 (图 2-2, 1n),但是只得到了消旋或者较低对映选择性的产物。其他类型的手性磷酸 (图 2-2, 1o-1s) 也做了检验,但是并没有取得更好的结果。于是我们就将催化剂定为 1l 来进行其他条件的筛选。
........
第三章 过渡金属促进的醇的需氧氧化反应研究进展.............55
3.1 引言 .......55
3.2 过渡金属促进的醇的需氧氧化反应的机理......55
3.3 Ru 催化的醇的需氧氧化反应 ........57
3.4 Pd 催化的醇的需氧氧化反应.........60
3.5 Cu 催化的醇的需氧氧化反应 ........63
3.6 Fe 催化的醇的需氧氧化反应.........71
3.7 Co 催化的醇的需氧氧化反应 ........74
3.8 其它金属催化的醇的需氧氧化反应 .......77
3.9 结论 .......79
参考文献.....80
第四章 Al(salalen)催化不对称合成 α-羟基磷酸酯的研究.......89
4.1 引言 .......89
4.2 结果与讨论......90
4.3 结论 .......98
4.4 实验 .......98
4.5 产物结构表征数据 ............101
第四章 Al(salalen)催化不对称合成 α-羟基磷酸酯的研究
4.1 引言
近年来,活性 α-羟基磷酸酯及其衍生物由于作为抗菌剂、酶抑制剂、抗癌药物、抗 HIV 病毒药物及植物生长调节剂等生物活性1而在现代药物化学中受到广泛关注 (A, 图 4-1)。一般来说,不对称合成 α-羟基磷酸酯的途径主要有三种:1) 烷基磷酸酯的不对称羟基化反应 (B, 图 4-1, path a)2;2) 羰基磷酸酯的不对称还原反应 (B, 图 4-1, path b)3;3) 羰基化合物的不对称磷酰化反应,即Pudovik 反应和 Abramov 反应 (B, Scheme 4-1, path c)4,5。上述三种策略中最常用的就是第三种方法。例如,Shibuya 课题组报道了一例 La-Li-BINOL 复合物催化的芳基甲醛的不对称磷酰化反应。最近,Katsuti 课题组报道了一例活性的C1-不对称 Al(salalen)催化的醇的磷酰化反应5b。Feng 课题组也报道了一例手性的三齿的席夫碱 Al(III)化合物催化的不对称 Pudovik 反应来合成一系列高对映选择性的 α-羟基磷酸酯5d-g。You 课题组发展了一种高活性的双官能团催化的亚磷酸酯对醛类化合物的不对称加成反应5h。Yamamoto 课题组报道了一例bis(8-quinolinato)(TBOx)配体和 Et2AlCl 配合物催化的不对称磷酰化反应5i。Ooi课题组利用手性三氨基亚胺正膦催化剂也高效地完成了不对称 Pudovik 反应5j,w。纵观之前的报道,他们都是以醛类化合物为起始原料进行的不对称磷酰化反应,此类化合物稳定性较差,容易被氧化,而以醇类为化合物为起始原料进行不对称磷酰化反应还尚未报道。
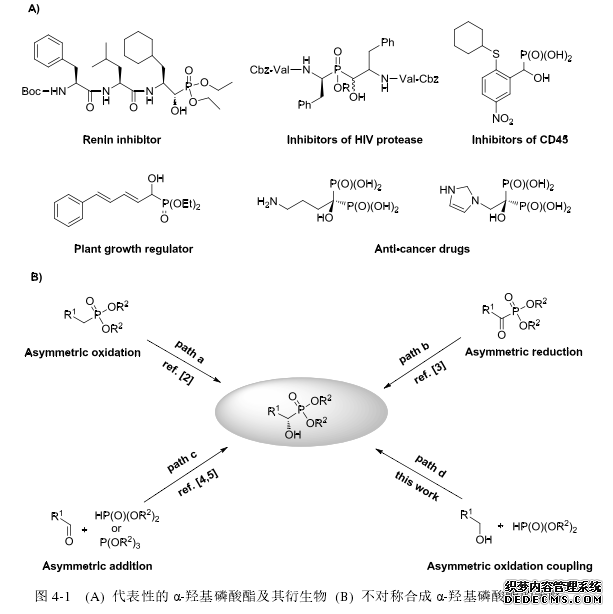

......
结论
我们发展了一种以伯醇和亚磷酸酯为原料,CuOTf/TEMPO/NMI 和手性Al(salalen)为催化剂的不对称氧化偶联反应来合成一系列的手性 α-羟基磷酸酯化合物。该反应原料易得,催化体系简单,反应条件温和,底物适用性广,特别是该反应以催化量的铜和空气替代传统的当量的氧化剂,体现了其绿色,经济,高效的优点,也为工业化提供了可能。
..........
参考文献(略)

