本文是一篇硕士论文,硕士是一个介于学士及博士之间的研究生学位(Post-Graduate),拥有硕士学位者通常象征具有基础的独立的研究能力。(以上内容来自百度百科)今天为大家推荐一篇硕士论文,供大家参考。
前言
1. NAFLD 的流行病学
全球大约 25%的成年人患有非酒精性脂肪性肝病(NAFLD),南美洲和中东的患病率最高,而非洲最低[1]。人口学特征(年龄,性别和种族)和代谢修饰基因(代谢组学成分)影响 NAFLD 的发生发展。欧洲和非洲血统的人群极少出现 NAFLD,严重肥胖患者以及糖尿病患者更倾向于发展为 NAFLD。NAFLD 在 2 型糖尿病患者的发病率无明显性别差异,而对于非糖尿病患者,男性的发病率较高[2]。在北美洲,非酒精性脂肪性肝炎(NASH)的患病率波动于 29.9%~59.1%,而亚洲的患病率为 6.7%。经肝穿刺活检诊断为 NASH 的患者平均每年肝纤维化进展率为 0.09%,这些患者中大约有 40%随着时间的推移会进展到更严重的阶段[1]。NAFLD 患者原发性肝癌(HCC)的年发病率为0.44/1000,而 NASH 患者为 5.3/1000。与非 NAFLD 患者相比,NAFLD 患者暴露于肝脏相关疾病死亡的风险几乎增加了两倍[1],致命性和非致命性心血管事件的风险也显著增加。
.........
2.1 NAFLD 与肝脏相关疾病
在 NAFLD 的病程有四种临床病理变化:单纯脂肪变性,NASH,晚期纤维化/肝硬化,原发性肝细胞癌。目前研究主要集中在每一种临床病理相互转变的影响因素。
2.1.1 单纯脂肪变性
正常肝脏几乎没有任何脂肪含量。而大多数 NAFLD 患者会出现单纯脂肪变性(> 5%肝细胞发生脂肪变性),通常伴有轻度慢性炎症。脂肪变性的结果与多种因素相互作用有关,包括年龄、性别、生活方式[3]。体重反映饮食习惯和体育锻炼,是 NAFLD 的主要决定因素。体重仅仅增加 2-3 公斤也可能增加 NAFLD 进展的风险[4]。
2.1.2 非酒精性脂肪性肝炎
非酒精性脂肪性肝炎(NASH)表现为肝细胞脂肪变性、轻度炎症改变以及“气球样变”,在 NAFLD 病例中可达 30%[3]。NASH 的危险因素是:高龄、男性和各种遗传、代谢危险因素[5]。NASH 从早期进展到肝硬化大概需要 24年,而单纯脂肪样变则需 57 年[6]。格列酮类药物不能有效逆转肝细胞气球样变,这一发现说明肝脏或者全身胰岛素抵抗在 NAFLD 发展的早期阶段起着关键的作用,而不是维持其后续进展[7]。
2.1.3 肝脏纤维化及肝硬化
年龄、体重指数(BMI)、性别、遗传和内分泌代谢因素是 NASH 进展为肝脏纤维化的危险因素[8]。肝脏纤维化预示 NAFLD 患者的肝脏相关死亡率升高。NASH 相关肝硬化表现为组织学上出现高级别纤维化和结节状改变,但是随着时间延长,脂肪变性可能消失[9]。肥胖、2 型糖尿病、脂肪变性以及动脉粥样硬化斑块与肝纤维化、肝硬化密切相关[10]。
2.1.4 原发性肝癌
相比其他病因引起的原发性肝癌(HCC),NAFLD-HCC 的男女比例有所下降,可能不伴有肝硬化。NAFLD-HCC 通常比较晚确诊,其总体预后较病毒性肝炎相关肝癌的预后差[11]。PNPLA3 I148M 的多态性、年龄、BMI、2 型糖尿病、饮食习惯和药物可能双向调节 NAFLD-HCC 的发展[12]。
...........
2.2 NAFLD 与心血管疾病、糖尿病
心血管疾病(CVD)是 NAFLD 患者死亡的主要原因。与非 NAFLD 患者相比,NAFLD 患者发生致死性和非致死性心血管事件的可能性更高,并且随着 NAFLD 的进展,其发生率增加。尽管 NAFLD 以及 NAFLD 严重程度和心血管疾病密切相关,但是仍需高质量的干预研究来进一步证实两者之间的因果关系。鉴于 CVD 经常决定 NAFLD 的结局,建议对 NAFLD 患者常规进行心血管系统疾病的筛查,至少要有详细的风险因素评估[13]。NAFLD 与亚临床心肌重塑和功能失调(如功能性和结构性心肌病)、心脏瓣膜疾病(如主动脉瓣硬化或二尖瓣环钙化)有相关,并且可以增加永久性房颤的发病率[14]。此外,NAFLD 还可以增加 QT 间期延长、室性心律失常的发病率[15]。初步证据还表明,NAFLD 可以增加急性心功能衰竭患者的 1 年再住院率[16]。长期以来,NAFLD 一直被简单的认为是代谢综合征在肝脏的表现,然而大量回顾性和前瞻性观察研究表明,NAFLD 是 2 型糖尿病和代谢综合征发生的预测和决定性因素。一项 5 年的随访研究表明 NAFLD 使 2 型糖尿病和代谢综合征的发病率几乎增加了 2 倍[17]。通过改善 NAFLD 与降低 2 型糖尿病发病率之间有着强烈而独立的关联[18]。因此,需要进一步的干预控制研究来明确治疗 NAFLD 可以降低 2 型糖尿病的发病风险。
..........
结果......14
1. 各饮食组小鼠的肝脏病理改变分析......14
2. MCDD 小鼠肠道细菌变化分析.....15
3. HFD 小鼠肠道细菌变化分析........18
4. CD-HFD 小鼠肠道细菌变化分析..........21
讨论......25
讨论
1. NAFLD 动物饮食模型的构建
随着肥胖和胰岛素抵抗的日益流行,NAFLD 在世界范围内的患病率不断增加,并且正在成为慢性肝病常见的原因之一。NAFLD 是以肝细胞脂质过多累积为特征的疾病,它可以从单纯脂肪变性发展为非酒精性脂肪性肝炎(NASH)甚至肝纤维化、肝硬化。然而,NAFLD 的确切发病机制仍不清楚。鉴于 NAFLD 患病率的快速增长,进一步研究致病途径和潜在的药物治疗是至关重要的。反映人类 NAFLD 各阶段的组织病理和病理生理特点的动物模型为理解 NAFLD 的发病机制提供了重要的指导作用。
1.1 MCD 与 NAFLD 小鼠模型
MCD 通常被用来构建 NASH 小鼠模型。Yamada T 等人发现 MCD 饮食小鼠在第 2 周就出现大片肝脏炎症,第 6 周后出现明显肝脏纤维化改变[38]。本研究中 MCD 小鼠在第 4 周肝脏表现为明显脂肪变性及大片炎症细胞浸润,与前人构建的 MCD 模型还是比较相符的。而且既往研究发现,与人类 NASH 相反,MCD 小鼠出现体重下降,血清胰岛素水平、空腹血糖、瘦素和甘油三酯水平下降,而不是肥胖和胰岛素抵抗。在本研究中未对 MCD 小鼠的体重动态监测,未测定相关生化指标如血胰岛素、血脂、血糖等变化,是本研究存在的缺陷。尽管如此,我们还是证实相比其他饮食模式,MCD 小鼠模型可以更好的模仿人类 NASH 病理改变。
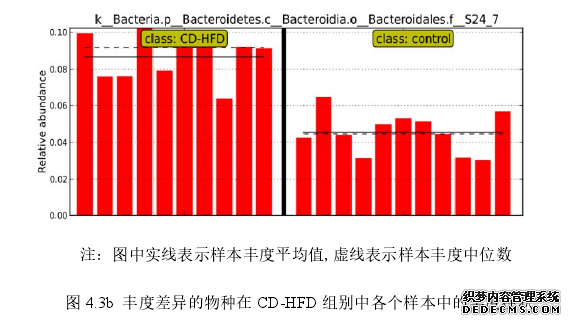

..........
结论
1.不同饮食构建的 NAFLD 动物模型其肝脏病理改变不同,MCD 可能更适合用于构建 NASH 模型。
2.不同饮食构建的 NAFLD 动物模型其肠道菌群改变存在差异,毛螺菌科及S24-7 菌增加可能与 NAFLD 的发生发展相关,但是具体机制有待进一步研究。
..........
参考文献(略)

