基础医学论文哪里有?笔者经过研究,得出以下结论:(1) KLF7、IL-6 高表达以及 p21 低表达,与肥胖相关 PCa 发生发展密切相关。 (2) 高水平 FFA C8:0 通过 GPR84 上调 KLF7 表达,促进 PCa 细胞的生物学行为。 (3) IL-6、p21 可能是 KLF7 的下游靶基因;KLF7 可通过上调 IL-6 表达,下调 p21 表达,促进 PCa 细胞的生物学行为。
实验材料
1.1 人体样本来源及实验动物
肥胖脂解作用增强引起血浆中游离脂肪酸(Free fatty acids, FFAs)含量增加,引起脂质代谢紊乱[12]。已有研究表明,肥胖状态下血清及前列腺周围脂肪组织中大幅升高的FFAs 是 PCa 细胞的主要能量来源[13-15]。除此之外,高水平的 FFAs 还可能是 PCa 细胞增殖、侵袭能力增强,甚至是去势抵抗和骨转移的重要信号调节分子[16-18]。值得注意的是,人体内脂肪酸可有多种分型,不同分型脂肪酸在各类疾病中的作用不同,而与 PCa发生发展相关的具体 FFAs 分型目前尚不明确[19]。课题组前期研究发现:PCa 患者血清中的中链脂肪酸——辛酸(FFA C8:0)含量显著高于非癌个体,且 PCa 骨转移患者血清中FFA C 8:0 含量进一步升高[18]。以上结果提示:血清 FFA C8:0 含量升高,可能是肥胖诱发 PCa 的重要危险因素,但其具体的作用机制目前尚不明确。
经医学伦理委员会批准(编号: 2017-049-01),PCa 患者的新鲜肿瘤组织与前列腺增生个体的新鲜前列腺组织来自石河子市人民医院。经医学伦理委员会批准(编号: A2017-115-01),于维通利华实验动物技术有限公司购买雄性 BALB/cNude 小鼠购并饲养于新疆医科大学动物实验中心。

实验结果
3.1 PCa 患者肿瘤组织中 GPR84、KLF7 及相关因子的表达水平
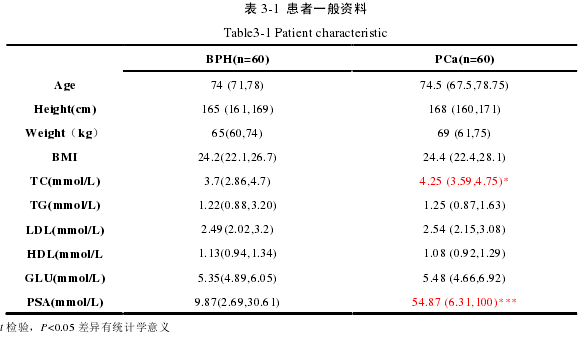
3.1.1 PCa 患者血清 PSA 及一般生化指标分析
收集经临床病理诊断结合血清 PSA 检测结果确诊为 PCa 患者以及前列腺增生(BPH)患者的前列腺组织各 60 例,分析两组间一般资料和生化指标后结果显示:PCa 患者体重、BMI 以及血清 GLU、TG、LDL 含量高于 BPH 患者,血清中 PSA 及 TC 含量显著高于 BPH 患者(P<0.05)。结果见表 3-1。
3.1.2 IL-6 和 p21 可能是 KLF7 的下游靶基因
利用加权基因功能富集分析工具 WEAT 软件分析发现:KLF7、p21、NF-κB 这几个基因都属于 SMAD2 靶基因集合(P<0.001)和 SMAD3 靶基因集合(P<0.001)。根据KnockTF 数据库 Gene Ontology 注释信息发现:KLF7、IL-6 和 p21 都参与脂肪合成通路。以上结果提示:IL-6 和 p21 可能是 KLF7 的下游靶基因。
讨论
一、肥胖状态下,含量增加的 FFA C8:0 可促进 PCa 细胞增殖、侵袭和迁移
FFA C8:0 作为中链脂肪酸,因为容易被快速吸收且可轻易进入脑部组织而常常被用于阿尔兹海默症的研究[49, 50]。近年来,关于 FFA C8:0 在慢性疾病尤其是肿瘤中的研究逐渐增多,例如,Kulapong Jayanama 等人发现 FFA C8:0 的高摄入量与中老年人身体虚弱和死亡率增加密切相关[51]。Takao Iemoto 等人发现血清中高水平的 FFA C8:0 有望成为晚期大肠癌的生物标志物[52]。Azhar Mohamed Nomair 等人发现 FFA C8:0 在肝细胞癌患者血清中的含量显著高于肝硬化患者,甚至比 α-甲胎蛋白具有更强的阳性预测率[53]。但 FFA C8:0 在 PCa 进展中发挥何种作用目前尚未见其他研究报道。
本研究使用不同浓度 FFA C8:0 刺激两种不同恶性程度的 PCa 细胞后发现,两种 PCa细胞的生物学行为均显著增强,且非雄激素依赖性 PCa 细胞 PC3 对 FFA C8:0 的刺激更加敏感。此外,在水平 FFA C8:0 刺激下,PC3 细胞中癌基因 MMP2 的 mR NA 和蛋白表达水平均显著升高。以上研究结果提示:高水平 FFA C8:0 处理可显著增强 PCa 细胞的生物学行为,而高水平 FFA C8:0 通过何种分子机制对 PCa 细胞产生影响尚无文献报道。
二、转录因子 KLF7 在 FFA C8:0 促进 PCa 生物学行为中发挥重要作用
作为在细胞增殖、分化与脂质合成中均发挥重要作用的转录因子,KLF7 在以往的研究多集中于糖脂合成与代谢[54, 55]。近年来,KLF7 在炎症因子的调节及肿瘤的进展中所发挥的重要功能逐渐被多次发掘。例如,W-H Huang 等人发现,KLF7 可增强心外膜脂肪组织中 JNK-NF-κB 信号通路来介导巨噬细胞活化,进而增强炎症因子累积[29]。另有多篇研究指出:高表达的 KLF7 可促多类肿瘤(如骨肉瘤、舌鳞状细胞癌、高级别浆液性卵巢癌、非小细胞肺癌等)的进展中发挥重要调控功能,而 KLF7 与 PCa 发展的关系目前鲜有研究报道[30, 56-58]。本实验通过比较 PCa 患者肿瘤组织与前列腺增生个体的前列腺癌组织发现,PCa 患者肿瘤组织中 KLF7 的蛋白表达水平显著高于前列腺增生个体;之后本实验在成功构建了肥胖伴原位 PCa 荷瘤小鼠模型的基础上发现,肥胖状态下 PCa细胞更容易在体内成瘤,且肥胖状态下 PCa 肿瘤组织中 KLF7 表达水平显著高于普通小鼠 PCa 组织;进一步在 PCa 细胞中上/下调 KLF7 发现:上调 KLF7 后显著促进了 PCa细胞的生物学行为,下调 KLF7 后显著抑制了 PCa 细胞的生物学行为。以上结果提示:高表达的 KLF7 在 PCa 发生发展中发挥重要作用。为验证 KLF7 是否参与 FFA C8:0 对PCa 细胞生物学行为的促进作用,本研究在 FFA C8:0 刺激 PCa 细胞的同时下调 KLF7后发现:下调 KLF7 可显著逆转 FFA C8:0 对 PCa 细胞生物学行为的促进作用。以上结果提示:FFA C8:0 可通 KLF7 促进 PCa 细胞的生物学行为。
结论
(1) KLF7、IL-6 高表达以及 p21 低表达,与肥胖相关 PCa 发生发展密切相关。
(2) 高水平 FFA C8:0 通过 GPR84 上调 KLF7 表达,促进 PCa 细胞的生物学行为。
(3) IL-6、p21 可能是 KLF7 的下游靶基因;KLF7 可通过上调 IL-6 表达,下调 p21 表达,促进 PCa 细胞的生物学行为。
参考文献(略)

