本文是医学论文,本论文采用DNA纳米技术,以精准调控药物的释放为出发点,设计并构建基于DNA纳米材料的智能药物递送系统,实现精准给药,增强药效并降低生物毒性,促进精准医疗的发展。具体结果如下:1.提出了一种基于适配体-配体toehold交换的肿瘤治疗新策略。与其它治疗策略相比,利用DNAtoehold开关用于爆破式释放具有以下显著特点:(i)SNAgels易于设计和构建,只需线性聚合和支链聚合即可;(ii)合理设计ATP-响应的toehold开关和sgc8适配体赋予SNAgelsATP-响应特性和靶向性,使更多SNAgels被靶细胞内化;(iii)ATP触发的爆破式释放促使药物在短时间内达到药效浓度,可减少给药剂量,实现药物疗效最大化;3.开发了基于Fe-DNA/GOx@MOF的化疗动力学治疗平台。与其它ROS-介导的治疗策略相比,该平台具有以下诸多独特优势。首先,生成的ROS是在生物环境中进行芬顿反应产生的,不需额外的氧气和外部能量输入,可解决当前ROS-介导的治疗模式问题,如有限的光穿透深度、缺氧相关的耐药性和超声诱导的热疗。其次,通过将Fe-DNA触发芬顿反应生成•OH和GOx催化葡萄糖产生H2O2结合,基于DNA/GOx@MOF的治疗平台能够通过级联反应大大提高肿瘤细胞内的ROS水平,从而获得显著的化学动力学疗效。三,由于EPR效应和肿瘤酸效应-激活的级联反应,该平台可以在体内选择性诱导肿瘤凋亡,并具有最小的副作用。
.........
第一章绪论
在DNA纳米技术诞生后的头二十年里,Seeman提出的寡核苷酸组装瓦片及基于瓦片的纳米阵列和纳米结构是这一领域的主要研究课题。利用序列的对称性,通过退火可以合成纳米物体、周期性阵列甚至三维晶体,其设计的优越性是显而易见的。当然,用瓦片自组装设计DNA纳米结构也存在着局限性。需通过计算机辅助程序来优化设计的瓦片序列;此外,瓦片的形成往往需要对个别寡核苷酸链进行精确的化学计量和纯度控制,这也是一个耗时的过程。由于相对简单的几何形状或基本瓦片的重复,纳米结构的复杂性也是有限的。自组装的DNA纳米阵列和纳米结构的可寻址表面积和直径也受限于单个瓦片的尺寸。DNA折纸术的出现是DNA纳米技术发展的一个里程碑。2006年,Rothemund提出一种把长单链DNA分子折叠成任意二维形状的简易方法100。在该方法当中,一条有7千碱基的M13mp18基因组DNA作为特定形状的DNA支架,200多条短寡核苷酸作为订书机链用来固定DNA支架(图1-3a)。经过合理设计之后,订书机链与DNA支架的特定区域互补,从而引发自组装过程。Rotherund课题组利用DNA折纸术发展了多种形状的DNA纳米结构(正方形、三角形、笑脸和五角星等),尺寸约为100nm。相比于基于瓦片自组装,DNA折纸术自组装具有以下优点:第一,折纸结构形状通常是已定义好的,大小比基于瓦片自组装的DNA纳米结构大达一个数量级;其次,设计DNA折纸结构无需优化序列;第三,不像基于瓦片组装需要严格控制寡核苷酸链的化学计量比和纯度,DNA折纸可以使用未经纯化的寡核苷酸链组装(寡核苷酸链与M13mp18长链的摩尔比,产量可高达90%以上。这些特性使得DNA折纸术成为一种简单而强大的设计技术,加速了DNA纳米技术的发展。
........
第二章DNAtoehold开关编程药物释放动力学用于爆破式释放
2.1引言
提高在肿瘤部位的药物递送和增强胞内的药物释放是化疗的关键303,304。为此,科研工作者开发了各种智能药物递送系统(DDSs),旨在提高药物的生物特异性和递送效率,从而提高治疗效果、降低细胞毒性17,305。例如,构建针对肿瘤微环境生理因素(如氧化还原电位、酶活性、pH)-响应的载药系统可使DDS在目标位点积累,并在肿瘤细胞中按需地实现药物的可持续释放306。尽管这样的智能药物递送载体,如脂质体、聚合物纳米颗粒和无机纳米材料,可利用这些可触发的信号调节药物动力学和操控药物的生物分布,从而增强治疗效果307,但是仍难以精确控制细胞内的药物释放308,309。此外,药物在肿瘤细胞内释放缓慢,难以达到最低的治疗浓度,导致治疗效果不佳310。因此,十分迫切开发一种可在定点主动释放药物的DDS平台,用于提高治疗效果、降低细胞毒性311,312。基于沃森-克里克碱基互补配对原则,DNA分子作为构筑材料可用于构建可编程的生物功能纳米结构297。越来越多的证据表明:基于DNA的纳米材料具有精确的空间寻址性、位点特异性表面功能和显著的生物相容性,能实现特异性的肿瘤识别、精确的药物释放和定制化的治疗功能313,这些特性使其在癌症治疗上具有广阔的应用前景。此外,DNA自组装已经成为在纳米尺度上控制化学反应的有力工具75。例如,基于链置换反应(stranddisplacementreaction,SDR)的DNAtoehold开关已经越来越多地用于DNA计算314、催化级联315、分子马达和机器人316、基因表达的操控317、甚至复杂的胞内逻辑计算318。在一个典型的DNA开关中,突出的短单链部分称为“toehold”,它可编程SDR速率,实现从纳米级到宏观的动力学控制319-321。受此启发,本章节工作开发了一种配体-特异性的DNAtoehold开关工程化的球形核酸凝胶(SNAgel)DDS,用于在目标肿瘤细胞中的主动药物释放。通过在金纳米颗粒(AuNP)模板上原位聚合形成致密的DNA壳层,制备得到配体-特异性的DNAtoehold开关-嵌入的SNAgel。
2.2实验部分
在制备SNAgel之前,先利用pH-辅助和无表面活性剂的方法制备巯基DNA修饰的AuNP(20nm)323.通常,将4μL100μM巯基DNA加入至100μL10nMAuNPs中,随后快速加入2μLcitrate-HCl缓冲液(500mM,pH=3).待孵育20min之后,对混合物进行离心(12000rpm,15min,15ºC),去除游离的DNA;前后使用PBS(10mM,pH=7.4)对沉淀洗涤三遍,最终将沉淀分散在100μLPBS中,得到Au-I。SNAgel的合成依赖于HCR反应。Au-I(100L,10nM)表面修饰了具有直链结构的IDNA,可促发与M1Apt1(4μL,100μM)和M2B(4μL,100μM)的线性聚合(LP),反应4h之后得到线性聚合物。随后,线性聚合物与M3Apt1(4L100M)M4Apt2(4L100M)发生支链聚合反应,反应yh(y=0、2、4、8、12)得到SNAgel。最终,SNAgel经PBS洗涤三次后重新分散在PBS中待用。除了使用Cy5.5标记的M2B代替M2B外,SNAgel/Cy5.5的合成步骤与SNAgel一致;cSNAgel的合成只是用cM1Apt1和cM3Apt1替代M1Apt1andM3Apt1;cSNAgel1的合成只是用M4C替代M4Apt2。这样合成得到的cSNAgel无ATP-响应特性,cSNAgel1没有靶向功能。将SNAgel与Dox按优化比例(6nM:2M)孵育12h后,得到SNAgel/Dox。此外,通过元素图谱分析,观察到氮元素和磷元素(来自DNA)和铁元素均匀分布在水凝胶纳米颗粒中(图4-3)。在这里,水凝胶的形成是由于Fe2+离子与DNA分子(具有丰富的磷酸结合位点以及核酸碱基上拥有氮和氧原子)之间的配位相互作用而引起的456。此外还发现:改变Fe2+与DNA的摩尔比(从20:1变化为120:1)可以调节水凝胶的大小;同时保持其尺寸均一性和形状的均匀性(图4-4)。除此之外,不同的核苷酸与Fe2+的不同配位亲和力导致DNA的不同核酸碱基对Fe-DNA水凝胶的形成具有重大影响(图4-5)456。基于此,可以得出以下结论:通过控制反应条件可以精准合成Fe-DNA水凝胶。
第三章DNA-编程化学键调控药物释放用于耐药性癌症的治疗......77
3.1前言.......................................................................................................................77
3.2实验部分...............................................................................................................79
3.3结果与讨论...........................................................................................................87
第四章金属有机框架-生物矿化的DNA水凝胶用于增强化学动力学治疗.......................................................103
3.1前言.......................................................................................................................77
3.2实验部分...............................................................................................................79
3.3结果与讨论...........................................................................................................87
第四章金属有机框架-生物矿化的DNA水凝胶用于增强化学动力学治疗.......................................................103
4.1前言.....................................................................................................................103
4.2实验部分.............................................................................................................105
4.3结果与讨论.........................................................................................................111
4.4本章小结.............................................................................................................124
第五章总结与展望............................................................................125
.............
第四章金属有机框架-生物矿化的DNA水凝胶用于增强化学动力学治疗
4.1前言
化学动力学疗法(chemodynamictherapy,CDT),通过利用芬顿化学将内源性过氧化氢(H2O2)转化为羟基自由基(•OH),在过去的几年中已成为一种新颖的癌症治疗策略405-407。作为活性最高的活性氧物质(ROS),生成的•OH能够导致线粒体和质膜的氧化损伤,从而导致癌细胞的铁死亡。与常规的ROS-介导治疗策略(例如光动力疗法)相比,该策略不依赖于氧气和外部能量输入就能产生ROS的独特方式具有巨大的潜力解决以下相关问题,如乏氧相关的耐药性、有限的光穿透深度、长期生物毒性等408-410。因此,科研工作者大力开发了各种铁死亡诱导剂(如含过渡金属的纳米颗粒),触发芬顿(Fenton)或类芬顿增加胞内ROS水平用于癌症的CDT治疗411-420。但遗憾的是:尽管肿瘤细胞内具有较高的H2O2水平(达100μM),要获得令人满意的化学动力学疗效仍受限于H2O2浓度的不足421-423。因此,开发出能够自我供给H2O2的新型铁死亡-诱导剂用于Fenton反应从而增强化学动力学疗效是十分迫切的。水凝胶(hydrogels)是交联的聚合物网络。由于其可调的化学结构、物理性质、可控的降解性和天然的生物相容性,水凝胶可以用作生物医学中的支架材料424-427。尤其是基于DNA的水凝胶,由于核酸本身的独特特性(例如,显著的分子识别能力、精准的寻址能力、精确的可编程性)156,428-430,它们对封装货物的释放在空间和/或时间上的控制拥有前所未有的优势,因此广泛应用于生物传感、药物可控释放、生物成像和诊疗344,431-435。例如,通过杂交将将二茂铁碱基嵌入到DNA链中,Tan课题组构建了大小可控和可自降解的DNA纳米花,该材料展现了良好的癌症靶向能力,提高了药物的治疗功效436。
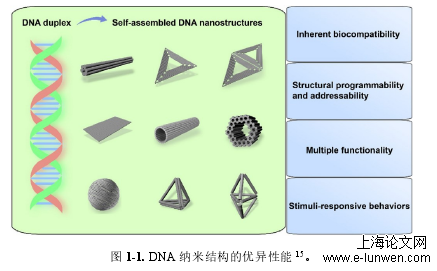
DNA纳米结构的优异性能
4.2实验部分
在本章节中对Fe-DNA/GOx@MOF的形貌、尺寸、元素组成和Zeta电位进行了相关表征。为了进行TEM表征,将分散好的样品滴入300目的无定形碳涂层的铜网格中,用JEM-2100F和200kV的EDS记录TEM图像和元素图谱。使用Zetasizer(NanoZS,Malvern)测试动态光散射(DLS)和Zeta电位。用日本岛津-KratosAXISUltraDLD进行X射线光电子能谱测量。使用带有活细胞培养箱的LeicaTCSSP8共聚焦显微镜监测细胞.使用FlowSight®成像流式细胞仪(Merck)进行流式细胞仪测定分析。本章中实验所用雌性无胸腺Balb/c裸鼠(4周龄)均从上海斯莱克实验动物有限责任公司购买.动物实验的所有操作均符合华东师范大学动物伦理委员会颁发的《实验动物护理与使用规范》规定。雌性无胸腺Balb/c裸鼠皮下肿瘤模型建立过程如下:体外培养4T1细胞,待细胞数目满足建模要求且处在对数生长期时,用胰酶消化分散细胞,在1000rpm转速离心沉淀细胞,遗弃上清液并用PBS缓冲液分散细胞,再次离心沉淀。最后用无血清的L-15培养基分散细胞,细胞浓度为2107mL-1。每只雌性无胸腺Balb/c裸鼠侧翼皮下注射0.2mL的细胞悬浮液。待皮下肿瘤尺寸增长至约50mm3,用于抗肿瘤研究。肿瘤的体积按以下公式计Tumorvolume=Length×Width2/2=L×W2/2。在制备这种新颖的诱导铁死亡纳米制剂之前,首先通过将Fe2+离子与polyA20DNA混合,利用配位驱动的自组装技术制备了Fe-DNA水凝胶。TEM图像显示合成的Fe-DNA水凝胶的尺寸约为82nm(图4-2a,中)。
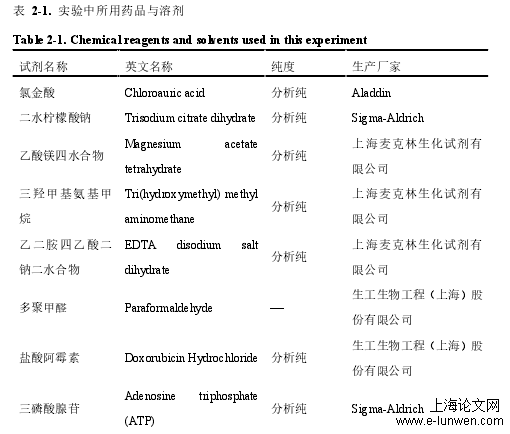
实验中所用药品与溶剂
.........
第五章总结与展望
在过去的二十年中,对用于增强药物递送和治疗效果的纳米材料已展开了广泛的研究。由于生物相容性较差、肿瘤靶向性不足、病变部位药物积累有限、生物毒性等原因,常规纳米载体的抗癌效果欠佳。基于DNA的纳米载体已成为一种整合纳米技术和生物科学优势的新型多功能平台,这在解决生物医学研究的关键问题方面显示出巨大潜力。总之,这项工作为开发具有增强化学动力学疗效的新型铁死亡-诱导纳米制剂提供了一个良好的范例。DNA纳米材料用于体内癌症治疗仍处于初期阶段。目前DNA自组装设计的纳米载体用于智能药物递送和可控释放大多局限于体外研究,这些智能载体如何在复杂的细胞环境中发挥作用不甚了解。研究并实现药物在胞内甚至体内的精准释放,结合成像技术实时监控智能DNA纳米药物递送系统的药物释放行为,有益于获取有关潜在临床应用的关键信息。此外,鉴于肿瘤微环境的异质性,在DNA纳米平台上设计多种靶向配体同时靶向肿瘤基质和肿瘤细胞有助于提高疗效并降低脱靶毒性作用。对多种膜受体进行分析有助于对单个病变细胞的特异性识别,从而实现更精准的疾病诊断和治疗。定制的DNA纳米载体为将来癌症治疗提供安全有效的个性化应用。智能DNA纳米载体的快速发展,在设计新治疗策略方面显示出巨大的潜力,也为机理研究和可能的临床应用提供灵活而强大的平台。
参考文献(略)

