缺氧复氧损伤,本文是医学论文,UCP2可减轻HR心肌细胞氧化应激、线粒体分裂,稳定线粒体动力学;加强证据链验证,设计UCP2过表达、沉默及单基因补救实验;③补充并验证UCP2在心肌HR损伤中的保护作用;④首次发现并验证UCP2-SIRT3通路在心肌中的保护作用;⑤首次发现并报道UCP2-SIRT3通路对线粒体氧化应激和线粒体动力学的保护。本研究的不足之处:①欠缺动物水平的研究证据;②本实验尽管改善研究策略,但在基因调控方面未能严格控制UCP2的过表达或沉默的程度,一个极端的可能是过表达不充分或沉默过重,导致得出UCP2过表达具有保护作用而沉默具有损伤加重作用的结论,因此,迫切需要探索UCP2表达的有效区间,即适度表达,按需“下药”
.......
1.前言
IRI表现为代谢紊乱、功能障碍及结构损伤的变化,其中始动环节是能量代谢障碍。心肌细胞超微结构改变表现为基底膜部分缺失、质膜破坏、线粒体极度肿胀、嵴断裂、溶解等,其发病机制如自由基损伤作用、细胞内钙超载和白细胞大量激活等均与线粒体结构及功能的完整性密切相关[5]。线粒体作为细胞内重要的细胞器,在心肌IRI中发挥重要作用,且目前关于抗心肌IRI的研究也逐渐趋向于对线粒体结构和功能的保护性研究[6,7]。SIRT3是NAD+依赖性去乙酰化酶家族成员之一,对线粒体氧化损伤特别敏感,其主要分布在心脏、肾脏和肝脏以及富含线粒体的其他组织和器官[18],并且主要位于线粒体基质[19]。SIRT3可调节线粒体蛋白的活化和表达,减少ROS生成,在稳定线粒体结构和功能及应激反应中扮演着重要角色[20,21]。最近的动物实验研究显示,在小鼠CLP脓毒症模型中,SIRT3具有心肌保护作用[22]。另外,在IRI小鼠心肌细胞中也发现,褪黑素可通过活化SIRT3来减轻线粒体氧化应激和心肌细胞凋亡,从而改善心肌IRI[23]。虽然,SIRT3在心肌线粒体中发挥重要作用,但其在心肌IRI保护中的确切机制仍不清楚,有待进一步探究。那么,UCP2能否通过调节SIRT3的表达,阻止或减轻IRI对心肌细胞造成的损伤呢?
......
1材料与方法
1.1主要实验材料
选取出生3天内的SPF级SD大鼠,浸于75%酒精中10s消毒并麻醉,眼科剪剪开胸腔、暴露心脏,眼科镊取出心脏,放入HBSS中洗净血液,去除主动脉根部及心房,将剩余心室肌剪碎,后转入混合酶液中,37℃水浴消化并借助转子晃动(每次5min),直至消化完成。每次消化后取上清,用含10%FBS的DMEM/F12完全培养基终止消化,800rpm离心5min,将重悬液汇于一管,100目筛网过滤于100mm细胞培养皿中,37℃细胞培养箱中静置90min,差速贴壁去除心肌成纤维细胞。吸取上清后,细胞计数板计数,用含5-嗅尿嘧啶的完全培养基稀释细胞悬液到合适密度,接种于细胞培养皿中,置于含5%CO2的37℃培养箱中培养,48h后换液,此时心肌细胞贴壁生长,后可对培养细胞进行实验处理。目前尚不清楚。因此,本研究主要为了:①明确UCP2对IRI心肌细胞是否有保护作用,表现在哪些方面以及发挥作用的内在机制;②初步探讨UCP2与SIRT3的关系,是否有调控作用及可能的上下游地位;③探究UCP2能否通过调控SIRT3的表达,发挥IRI损伤的心肌保护作用。
1.2主要实验试剂
以上溶解于超纯水,配制100mL并分装,保存于-20℃。使用前取适量,调PH至7.2~7.3,无菌滤头过滤后使用。2)混合酶液配制:酶液终浓度含0.1%胰蛋白酶和0.08%II型胶原酶,具体配制方法如:需要100mL酶液,则称取0.1g胰蛋白酶和0.08gII型胶原酶用HBSS溶解至100mL,无菌滤头过滤后使用。3)5-嗅尿嘧啶母液(100×)配制:称取0.0614g溶解于超纯水并配制成20mL,即得10mM5-嗅尿嘧啶母液(100×),无菌滤头过滤后使用,配制完全培养基时与双抗(100×)加入量一致,保存于4℃。NRCMs培养48h后,更换完全培养基为不含FBS和双抗的DMEM/F12培养基,每个培养皿加入一定体积的含GFP标签的对照腺病毒(空病毒或沉默对照病毒),使其MOI值分别为0、50、100、300、500,摸索病毒感染的最佳MOI值,并以此MOI值病毒滴度作为后续实验感染病毒的依据。病毒感染6~8h后更换含10%FBS和双抗的完全培养基,感染36h后进行RT-qPCR检测基因转导情况。

......
前言.............................................................................................................7
材料与方法.................................................................................................9
结果...........................................................................................................37
讨论...........................................................................................................84
结论...........................................................................................................91
......
3讨论
3.1NRCMs的分离培养
1960年首次报道采用分离培养的原代心肌细胞进行实验,开创了心肌细胞体外研究的先河[25]。原代心室肌细胞有其独特的优势[26]:虽处体外但兼有体内原有的结构和自律收缩等特性,可以高度模拟体内变化;另外,可以排除体内神经和体液调节对其反应的干扰;其次,心室肌搏动性能优于心房肌,位置远离心肺血管,便于取材且纯度更高。因此较于细胞株更贴近活体水平,更适合心血管疾病功能研究,但因其为永久细胞,消化、分离中难免受损,即便有报道称新生小鼠7天内心肌细胞具有分裂增殖能力[27],也远远不够实验所需,所以培养高存活率和高纯度的NRCMs一直是学者的研究方向。经过几十年的努力,大多研究者已能将细胞存活率和纯度提高到95%左右[28]。本实验经过前期学习和优化,分离并培养NRCMs48h后可见细胞贴壁生长,大多呈长梭形,局部跳动活跃,经肌钙蛋白鉴定细胞纯度达99%以上,因此,本研究可获得活性好、纯度高的原代心肌细胞,为心肌HR损伤模型提供良好的细胞工具。
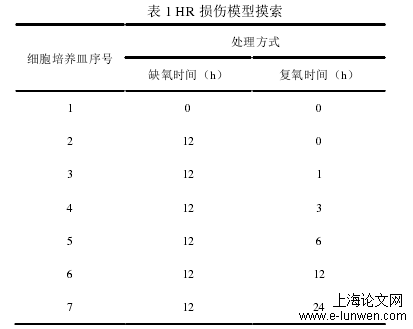
3.2心肌细胞HR损伤模型
缺血再灌注损伤是指组织器官在缺血上恢复血流灌注后,其结构和(或)功能反而恶化,甚至导致不可逆性损伤的一种复杂的病理生理过程[5],多种因素均可影响其损伤的时间和严重程度。体外HR损伤虽相对影响因素较少,但亦受细胞来源、种类、HR条件和时间等因素影响。目前,关于心肌HR损伤的处理条件和时间尚无统一规范,同种来源的NRCMs细胞,有的研究采用缺氧4h复氧3h作为HR损伤最佳时间[29,30],有些报道以缺氧8h复氧8h或者缺氧12h复氧3h作为适宜处理时间[31,32],以上差别除了与缺氧环境和缺氧装置的密闭性等不完全一致相关以外,也可能与研究目的不同有关,但相同之处均对HR处理后模型进行验证,大多以细胞凋亡或心肌损伤标志物等指标检测作以辅助。本实验探究结果以缺氧12h复氧3h(H12R3)为HR损伤建模时间,此时UCP2蛋白表达最高,同时检测心肌细胞活力、存活率、细胞凋亡和心肌损伤标志物CK、LDH、cTn-T等与常氧组(Normoxia)相比均明显改变,确定HR建模成功;另外,从透射电镜结果可知,形态学改变主要表现为内质网的扩张,说明本实验的HR模型多为可逆性损伤,这样更适合后期损伤表型的逆转性研究。
.......
4结论
本实验关于UCP2与SIRT3结合发挥作用的证据仍不够充分,需更多直接作用机制的实验探索。综上,本实验结果表明(如图31模式图):Normoxia条件下UCP2和SIRT3即存在基础水平的表达,用以维持机体功能稳定,保持细胞ROS含量处于低水平、ATP含量和线粒体膜电位处于高水平、线粒体动力学平衡;当HR损伤后,尽管UCP2和SIRT3存在部分高表达,但机体依旧处于失衡状态,ROS产生增加,ATP供应和线粒体膜电位降低,线粒体过度分裂;当UCP2过表达后通过调控SIRT3的表达,抵抗HR对心肌细胞的损伤,使ROS含量降低,ATP合成、线粒体膜电位和线粒体融合增加。
参考文献(略)
参考文献(略)

