本文是一篇医学论文,医学,是通过科学或技术的手段处理生命的各种疾病或病变的一种学科,促进病患恢复健康的一种专业。它是生物学的应用学科,分基础医学、临床医学。从生理解剖、分子遗传、生化物理等层面来处理人体疾病的高级科学。(以上内容来自百度百科)今天为大家推荐一篇医学论文,供大家参考。
前 言
肠道不仅是机体吸收营养物质的主要场所,也是抵御肠腔细菌和内毒素等有害物质侵入机体的重要防线。肠黏膜机械性屏障主要由肠道上皮细胞和相邻细胞间的紧密连接构成,其主要连接方式有紧密连接、黏附连接和桥粒连接,其中紧密连接和黏附连接在维持肠道屏障功能中发挥关键作用。紧密连接位于肠道上皮细胞膜的临侧边缘和顶端,形成了细胞旁路途经的第一道防线。在正常生理情况下,肠道上皮细胞间的紧密连接和黏附连接是完整的、动态平衡稳定的,能发挥有效的屏障作用。但在受到外界刺激或损害下,肠道上皮细胞正常形态变异、排列紊乱,上皮细胞间的有效连接受到破坏,导致肠道上皮细胞间距离增大,肠道屏障通透性增加,引起并加重肠道炎症反应,造成肠道组织病理损伤,进而引起肠道细菌及内毒素的移位并诱发全身感染,严重时可导致败血症的发生。败血症的发病率以及死亡率较高,仅在美国一个国家,每年就有 100 万人患病,并有 20 万患者死亡,是引起重症监护室(intensivecareunit,ICU)患者死亡的主要疾病之一。败血症并非一种单一疾病,而是一种系统综合症。通常是由于细菌,病毒和真菌的感染所致,但无菌组织损伤,包括胰腺炎、缺血再灌注损伤以及癌症等同样能引起败血症的发生。当前免疫学知识还不能对败血症中细胞功能紊乱,器官衰竭以及死亡进行解释,目前的内科治疗和外科手术同样不能有效治疗败血症患者。现代研究表明,肠道在败血症的发生中扮演重要角色,被认为是系统性炎症反应的发动机,而肠道又是败血症中主要发病器官之一。Zhang 等认为,肠道屏障的破坏在全身炎症反应综合征(systemic inflammatory responsesyndrome, SIRS)-脓毒症-多器官功能障碍综合征(multiple organ dysfunctionsyndrome, MODS)连续发生发展中具有至关重要的作用。因此肠道屏障的保护是预防和治疗败血症的关键。
GPR109A 属于 Gi 蛋白烟酸受体家族,介导烟酸的抗脂解作用。自 GPR109A被发现以来引就起了人们的广泛关注。Cho 等研究表明,GPR109A 能够抑制动脉硬化、肥胖、糖尿病和肾炎等多种疾病中的炎症反应。GPR109A 通过抑制炎性因子分泌、低密度脂蛋白摄入和化学趋化作用来抑制巨噬细胞的促炎功能。Digby 等研究发现,烟酸激活人单核细胞中的 GPR109A 从而起到抗炎功能。实验室前期结果发现,BHBA 激活 GPR109A 后,通过抑制 NF-κBp65 信号通路来抑制 LPS 诱导的小胶质细胞促炎因子 TNF-α、IL-6 和 IL-1β 的分泌,以及炎性蛋白酶 COX-2 和 iNOS 的合成。同时,有研究表明,GPR109A 被认为介导了菌群代谢物的作用,在抑制结肠炎,维持肠道屏障的完整性中发挥着重要的作用。Christian Jobin 等认为肠道菌群能够发酵食物中的粗纤维分泌丁酸物质,而丁酸激活位于肠上皮细胞、巨噬细胞和树突状细胞的 GPR109A,从而将肠道菌群与机体健康紧密联系起来。但是 GPR109A 与肠道菌群的具体联系是否单一,是否存在相互作用的关系,尚未见报道。鉴于上述,本实验利用CLP手术来建立以C57BL/6为背景的WT和GPR109A-/-小鼠败血症模型,通过荧光定量、组织免疫荧光、16SrRNA 测序等技术,来研究 GPR109A 是否能够维持败血症模型中肠道上皮的完整性,抑制肠道炎症,同时研究 GPR109A 与肠道菌群之间的具体联系,明确肠道菌群在败血症中的作用,以期为败血症的缓解和治疗提供理论依据。
..........
第一篇 文献综述
第一章 败血症与肠道屏障
1.1 败血症的概念
败血症(Sepsis)一词来源于古希腊语,意思是腐烂、腐败、腐朽。Galen 和Celsus 将败血症描述为,发炎、毛细血管扩张、发热、毛细血管通透性增加、器官功能障碍[1]。现代理论认为,败血症是指人类对微生物入侵的反应。2016 年第三次北美学术会议一致认为败血症是一种系统综合症,通常是由于细菌,病毒和真菌的感染导致的 SIRS,包括发热、白细胞升高或降低、血管阻力降低导致的低血压(脓毒性休克,sepsis-3)、器官衰竭(重症脓毒症,severesepsis)和死亡[1-3]。败血症定义的模糊和无效的临床策略导致了败血症发病率和死亡率的差异[4]。现代理论重新对败血症和 sepsis-3 进行了定义,指出了以前过分关注 SIRS 和炎症的局限性[5],废除 SIRS 标准。同时会议报告揭露了一种误导,败血症并不总是沿着 SIRS-重症败血症-sepsis-3 这种线性关系发展,而是属于并列交叉关系。败血症被重新定义为,生命受到威胁的器官功能障碍,是由宿主对感染的应答调节障碍所引起。器官功能障碍被重新定义为连续的器官功能障碍评估(sequentialorganfailureassessment,SOFA),且必须满足或超过以下两项标准(真实死亡率超过 10%),包括 PaO2/FiO2比降低、血小板浓度降低、格拉斯哥评分降低、胆红素升高、肌酸酐升高、排尿量变少以及血压过低或过高[6]。Sepsis-3 现在被认为包含于败血症范畴,细胞和代谢异常比败血症本身更能引起死亡,在临床上平均动脉压达到或超过 65 mmHg,或者血清乳酸浓度超过 2mmol/L 才会被称为 sepsis-3(真实死亡率超过 40%)。为了快速识别败血症,qSOFA 被应用,并且规定必须满足以下至少两个条件才能被确认为是败血症:呼吸率达到或超过 22 次/min,精神状态不佳,收缩压降到 100mmHg 或更低[6]。
............
1.2 败血症的临床特点
败血症的发病率以及死亡率较高,仅在美国一个国家,每年就有 100 万人患败血症,并引起 20 万患者死亡[7, 8]。临床知识的不断丰富,免疫、病理、生理学知识的不断更新,整体提升了败血症的存活率,然而长期患有败血症的病人的死亡率依旧是 40%-80%[9]。随着抗生素疗法,辅助呼吸设备,心脏复苏设备,血糖维持等治疗措施不断进步,败血症患者病情有所改善,然而,败血症依旧是引起ICU 患者死亡的头号杀手[10]。种族和地理位置,甚至健康状况都不是患上败血症的主要原因,结合多组数据还是不能解释患者的存活或者死亡[7]。美国每年就败血症相关的医疗费用就高达 170 亿美元[11],考虑到老龄化人口越来越多,生理虚弱,免疫衰老[12],未来 20 年内由败血症引起的死亡数还会持续增加[13]。研究人员提出了多种假说来对败血症进行解释,包括受损的细胞代谢、组织氧化、心肌抑制[7],持久的、复杂的免疫与炎症反应的互相影响广泛被人们所接受[14],然而通过阻断 IL-1β 和 TNF-α 来抑制炎症反应后依然不能降低患者的死亡率[15]。在过去的 20 年里,临床治疗策略的不断改进,使更多的败血症和器官功能紊乱的病人存活了下来[16],但仍会长期伴有免疫功能障碍、免疫抑制[17]、持续炎症以及新陈代谢异常等症状[18]。
..........
第二章 GPR109A 与肠道菌群的关系......41
2.1 材料与方法 .........42
2.2 结果............45
2.3 讨论............50
2.4 小结............52
第三章 肠道菌群对 CLP 败血症小鼠模型的影响......53
3.1 材料与方法 .........54
3.2 结果............56
3.3 讨论............65
3.4 小结............66
第三章 肠道菌群对 CLP 小鼠的影响
人类肠道微生物是一个非常复杂的生态系统,主要是细菌,还包括真菌,寄生虫,病毒和古生菌[251]。拟杆菌门和厚壁菌门在肠道菌中占有绝对优势,占比超过 90%,其余可分为 4 类,放线菌门、梭杆菌门、变形菌门和疣微菌门。肠道菌群在门分类中数量较少,但是在种分类中非常丰富[252]。每个个体都有自己特有的菌群群落,且不是长期固定不变的,环境因素能影响菌的相对丰度,但不会使这些永久定殖的菌消失[253, 254]。肠道微生物在宿主代谢过程中扮演重要角色,有利于黏膜和系统免疫的发育和成熟[55],同时共生菌通过竞争在肠道内的生存空间来间接影响阻碍病原菌在肠道内的定殖,且可以直接降低涉及病原菌毒力因子的基因表达[255, 256],对于维持宿主肠道稳态必不可少。肠道免疫系统的发育和成熟依赖于肠道微生物,肠道微生物同时在调节肠道免疫系统活化中扮演重要角色[257]。例如 T 调节细胞的缺乏将导致对肠道微生物抗原以及肠道炎症产生过度的适应性免疫反应[258, 259]。同时,肠道菌通过控制促炎和抑炎 T 细胞的数量来调控宿主全身免疫应答[260-262]。T 细胞增殖平衡受微生物群和它们的代谢物影响,T 细胞区域的扩张有助于自身免疫疾病的发生[263, 264]。近些年来,人们一直致力于研究宿主与肠道菌群的相互作用关系,其目的就是为了逐渐了解几种复杂疾病的发病原因[265]。增强宿主与肠道微生物相互作用的理解有助于疾病的诊断,治疗和预防[266]。研究表明,在IBD患者中肠道菌的组成以及代谢能力都将改变[267-270]。现代高通量技术的运用更加证明了此观点,炎性肠疾病源于肠道菌群与黏膜免疫系统相互作用的改变,那么调节肠道菌群结构就有可能治疗炎性肠疾病。现代医学就在尝试用健康人的粪便菌群来治疗患者炎性肠疾病,同时出现菌苗片剂来调节肠道菌群结构来治疗肠道疾病。本实验第二章部分证实,GPR109A能够调节小鼠肠道菌群,且发现CLP手术后肠道菌群组成发生剧烈变化。那么肠道菌群在CLP诱导的败血症中发挥了什么样的作用,是加重还是能缓解CLP诱导的败血症症状值得我们探究。参照肠道菌群与IBD的关系,能否通过菌群移植来缓解CLP诱导的败血症也值得我们探究。本章实验即探讨肠道菌群在CLP诱导的败血症中的作用,为败血症的缓解或治疗提供理论依据。#p#分页标题#e#
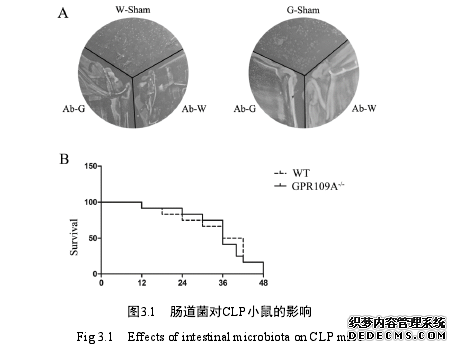

..........
结 论
1、GPR109A 抑制 CLP 小鼠炎症反应并维持肠道屏障完整性的破坏。
2、GPR109A 能够调节小鼠肠道菌群结构。
3、WT 小鼠的肠道菌可有效缓解 GPR109A-/-小鼠 CLP 造模后的炎症反应并维持肠道屏障的完整性。
..........
参考文献(略)

