本文是一篇医学论文,医学可分为现代医学(即通常说的西医学)和传统医学(包括中(汉)医、藏医、蒙医、维医、朝医、彝医、壮医、苗医、傣医等)多种医学体系。不同地区和民族都有相应的一些医学体系,宗旨和目的不相同。印度传统医学系统也被认为很发达。(以上内容来自百度百科)今天为大家推荐一篇医学论文,供大家参考。
前 言
周围神经损伤后,其功能恢复很大程度上取决于损伤部位的轴突能否正确再支配靶肌[1]。遗憾的是,即使应用最先进的现代显微外科技术,面神经修复后的功能恢复仍不理想,表现为面肌张力不足、自主运动不协调以及面部表情不自然[2]。从神经生物学角度而言,这些现象可能与损伤部位再生轴突侧索发芽(collateral sprouting)、靶肌内末梢轴突发芽(Terminal Axon Sprouting,TAS)、再生轴突间冲动的相互交换所导致的错向再支配(misdirected reinnervation)或迷乱再生(aberrant regeneration)有关[3]。周围神经切断后会发生一系列内在和外在事件,损伤部位钙、钠离子泄漏产生损伤电流,增加细胞因子的产生,丢失来自靶肌的营养因子;损伤近端则出现神经元肿胀、细胞核偏移、封闭近端轴突泄漏、形成轴球开始轴突再生;损伤远端神经发生华勒氏变性,包括轴突和髓鞘肿胀、收缩、崩解,雪旺细胞受细胞因子、营养因子、巨噬细胞因子激活,增殖、迁移、吞噬髓鞘和细胞碎片、产生细胞因子和营养因子,并沿着皱缩塌陷的内膜管排列形成 Büngner 氏带,为再生轴突向靶器官生长提供引导[4, 5]。 轴突再生初期,每根被切断的轴突侧索发芽,可以产生多达 25 个轴芽[6]。 过多的侧索发芽曾被认为有利于增加单个轴芽准确到达靶肌的机会[7]。虽然大部分轴芽会在数天内退化,但股神经切断修复 3 周后,邻近损伤部位的远端神经内轴芽的数量是近端轴突数的 3 倍以上[8]。再生轴突的发芽能力对于混合神经修复再生可能是有利的。Brushart 建立了一个股神经再生模型,尽管近端的运动神经有相同的机会进入远端的运动和感觉神经,但再生的运动神经选择性地向远端的运动神经方向生长,此现象被称为优选运动再支配(Preferential Motor Reinnervation ,PMR)[9, 10]。Brushart等认为,这一现象可能与生长路径错误的轴芽逐渐被选择性的删除或修剪有关[9, 10]。与混合神经不同的是,颞骨外段面神经属纯运动神经,过多数量的轴芽到达靶肌可导致一根肌纤维受到多个运动神经元的支配而形成多支配终板(PolyinnervatedEnd-Plates,PEDs),而且这些神经元的功能常常有可能是相互拮抗的[11]。另一方面,一旦再生轴突到达失支配的靶肌,还会经历 TAS,同时支配多个运动终板(PEDs 的另一种形式)[12]。正常情况下,运动神经元具有很强的发芽能力,在部分失支配的肌肉和再支配的肌肉内,可以支配 5 倍以上的肌纤维[13, 14]。虽然肌内 TAS 可以补偿再生轴突数量的不足,但也是导致肌纤维运动不协调的重要原因。因为正常情况下,一根肌纤维只接受来自一个运动神经元发出的轴突支配,即单支配终板(Monoinnervated End-Plates,MEDs)。因此,严重的周围神经损伤后运动功能恢复不良的主要原因是不精确的靶肌再支配[12, 14]。
神经营养因子具有阻止神经细胞凋亡,促进神经细胞存活、发育、可塑性改变、以及神经元相关的酶合成,但由于机制不清,体内实验并未取得预期的效果[15]。立即修复周围神经损伤后局部给予外源性神经营养因子可以增加再生轴突发芽能力,但并不能加速运动神经元轴突的再生和提高功能恢复。Choi[16]、Guntinas-Lichius[17]等在面神经干损伤部位施加富含营养因子的神经胶质细胞(雪旺氏细胞、嗅鞘细胞、S型嗅鞘细胞),以期减少再生轴突的错向生长,结果发现非但不能促进精确再生,还增加了轴突发芽的数量。此后,Guntinas-Lichius等[18]在面神经干损伤局部添加各种中和浓度的抗神经营养因子抗体,发现可以显著减少再生轴突发芽数量,其中以抗脑源性神经营养因子(Brain-Derived Neurotrophic Factor,BDNF) 抗体效果最明显,但触须运动功能的恢复并未因此得到提高。Guntinas-Lichius等[18]进一步比较分析了SD大鼠和SD/RCS盲鼠(该品种大鼠视网膜色素上皮基因缺失,出生2个月后失去光感受细胞,主要依靠触须感知外部空间信息)面神经干切断吻合后上唇提肌运动终板支配形式。结果发现,触须运动功能恢复好的SD/RCS盲鼠,靶肌PEDs比例少(占10%);触须运动功能恢复差的SD大鼠,PEDs比例多(占50%)。Bendella等[19]建立了一个同时切断吻合大鼠面神经干和同侧眶下神经的模型,术后剪除对侧触须、人工刺激同侧触须以及剪除对侧触须加人工刺激同侧触须的方法增加术侧感觉传入,术后4月,与单纯切断吻合组相比,处理组动物不仅显著恢复了触须摆动幅度(30°versus 11°),还显著减少了PEDs的比例(37% versus 58%)。最近,Grosheva等[20]研究发现,触须运动功能恢复好的SD/RCS盲鼠上唇提肌内BDNF和成纤维细胞生长因子-2(fibroblast growthfactor-2 ,FGF2)mRNA的高表达与再支配靶肌内TAS减少相一致。上述研究结果提示,感觉反馈可以影响神经功能恢复、触须功能的提高与PEDs的减少相一致、靶肌内BDNF和FGF2可能具有减少PEDs形成的作用。
..........
第一部分 大鼠上唇提肌 NCAM 蛋白和mRNA 的表达
在脊椎动物肌肉发育阶段,NCAM 在介导神经元轴突向横纹肌附着的过程中发挥了关键作用,在轴突、末梢雪旺细胞、肌纤维等处广泛表达[35, 36]。神经肌肉接触后,NCAM 即以活性依赖的方式在轴突和肌纤维中的表达明显下降[36]。在肌肉失支配和再支配过程中,NCAM 的再现有点类似神经肌肉的发育机制[35, 37, 38]。另外,NCAM 在稳定突触或 NMJs 功能方面也发挥了重要作用。相关研究主要集中在神经肌肉发育、突触稳定性和可塑性、瘫痪或失支配肌肉诱导的 TAS、突触功能异常相关的运动神经疾病等[24, 26, 35, 37-39]。轴突侧索发芽是外周神经损伤修复后轴突再生过程中普遍存在的现象。面神经干切断吻合后,除了过多轴芽到达靶肌可导致一根肌纤维受到多个运动神经元的支配形成 PEDs 外,近端轴芽在向远端生长的过程中,进入神经内膜管的轴芽能够获得更多的营养支持、较快到达靶肌形成新的 NMJs,而还处于失支配状态的肌纤维就有可能诱导 NMJs 内的 TAS,形成多个 NMJs(另外一种形式的 PEDs)。课题组在前期工作中,采用基于视频的大鼠触须运动分析方法,从功能角度确定了面神经干切断吻合后靶肌获得再支配的时间和程度;在触须运动功能恢复的 4 个时间点,采用神经元逆行示踪法记录、比较到达触须垫的运动神经元数量,初步明确了再生轴突到达靶肌的时间存在先后差异,即再生轴突存在非同步生长。本实验在前期工作的基础上,观察、比较、分析面神经干切断吻合后 2、4、8、12 周上唇提肌内 NCAM 蛋白和 mRNA 表达的变化,为进一步研究面神经再生后面肌 PEDs 的原因奠定基础。
一、实验材料
(一)实验动物
雌性成年健康 SPF 级 Sprague–Dawley (SD)大鼠(上海交通大学动物实验中心提供)72 只,体重 250-300g,于上海交通大学动物实验中心清洁级动物房内饲养,12h昼夜循环,温度控制在 24±2℃,湿度控制在 40~60%,标准实验室饲料喂养。实验方案经上海交通大学动物伦理委员会审查批准。
(二)手术器械
常规手术器械包括刀柄、15#手术刀片、蚊式止血钳、持针器、眼科小剪刀、缝针缝线等;显微外科手术器械包括血管夹、血管镊、持针器等。手术器械均经高温高压消毒后备用。
........
二、实验方法
(一)实验分组
实验共用大鼠 72 只,其中 64 只大鼠随机分成 4 个实验组,每组 16 只动物;另外 8 只大鼠作为正常对照。 FFA(facial–facial anastomosis, FFA)组:面神经干切断吻合(实验组);FFA+PS(physiological saline)组:面神经干切断吻合后上唇提肌表面注射生理盐水(实验组);FFA+P-NCAM-Ab 组:面神经干切断吻合后上唇提肌表面注射 P-NCAM-Ab(实验组);FFA+BDNF-Ab 组:面神经干切断吻合后上唇提肌表面注射抗 BDNF 抗体(实验组);Control 组:面神经及上唇提肌不作任何处理(正常对照组)。实验组动物按术后 2、4、8、12 周 4 个时间点随机分为 4 个小组,每小组 4 个动物;对照组动物按相应时间点随机分为 4 个小组,每小组 2 只动物取双侧上唇提肌,共 4 个标本。
...........
第二部分 大鼠上唇提肌 BDNF 蛋白和 mRNA 的表达........28
一、实验材料 ............28
二、实验方法 ............29
三、统计学方法 ........33
四、实验结果 ............33
五、讨论...........40
五、讨论#p#分页标题#e#
成年脊椎动物瘫痪或部分失神经支配的肌肉可以诱导未受损伤的运动神经末梢发芽,此现象被称为 TAS。TAS 在瘫痪或失支配肌纤维表面形成新的突触连接,有助于周围神经损伤后运动功能的自发恢复,但这种补偿作用的范围有限,大范围失支配肌肉的运动功能很少恢复[14, 34]。尽管一些弥散、表面黏附分子可能参与其中,但机制仍不清楚。一个似乎合理的策略是应用一些生长促进分子来增加未受损肌肉 TAS的数量。奇怪的是,神经营养因子诱导突触外发芽的能力是有限的。可能的原因是,神经肌肉连接处的非神经细胞(如肌纤维、末梢雪旺细胞)虽然参与调节、延长末梢轴芽,但对神经靶向因子的反应是有限的[46]。2007 年,Wright 等[46]将睫状神经营养因子(Ciliary neurotrophic factor, CNTF) 和 Btx-A 分别单独和联合注入小鼠耳长提肌诱导末梢轴突发芽。结果发现,CNTF 诱导了几乎所有末梢轴突发芽,但大多局限在突触范围内,很少有超出突触外生长;Btx-A 诱导的末梢轴突发芽活跃地出现在突触外的肌膜表面;同时注入 CNTF 和 Btx-A,出现了极其强烈的突触外发芽。他们解释这一结果为瘫痪诱导的肌内 TAS 与黏附分子有关,如 NCAM。2016 年,Grosheva等[20]对比研究发现,面神经干切断吻合后,触须运动功能恢复好的 SD/RCS 盲鼠上唇提肌内 BDNF、FGF2 蛋白和 mRNA 表达的显著增加与突触外 TAS 减少是共同发生的,提示高浓度的 BDNF 和 FGF2 可能有减少 PEDs 形成的作用。BDNF是神经营养蛋白家族(neurotrophin family)成员之一,其它成员还有NT-3(neurotrophin-3)、NT-4/5(neurotrophin-4/5)、NGF(nerve growth factor),它们具有50%的基因同源性[47]。神经营养蛋白在神经营养因子(neurotrophic factors)中具有独特性,它们可与二类受体结合。一类是原肌球蛋白受体激酶家族(tropomyosinreceptor kinase family,trk),另一类是肿瘤坏死因子家族(tumour necrosis factor family)受体p75,p75可以相似的亲和力与所有的神经营养蛋白结合,而trkA、trkB、trkC则分别与NGF、BDNF和NT-4/5、NT-3结合[47]。Boyd和Gordon[48]通过动物实验发现,外源性低剂量BDNF可以增加神经延迟修复后恢复轴突再生能力的运动神经元数量,而外源性高剂量BDNF则对立即修复或延迟修复后的运动神经元均有抑制其轴突再生的能力,并且这种抑制作用可以被抗p75受体抗体消除。他们认为,外源性高剂量BDNF通过p75受体发挥抑制轴突生长的作用,这种生长停止信号在失支配肌纤维上可能起到了启动神经肌肉突触形成的作用[48]。也就是说,外源性高剂量BDNF可能通过减少突触外TAS而有利于突触形成和成熟。Grosheva等[20]的实验结果也印证了Boyd和Gordon[48]的观点,即面神经干切断吻合后,触须运动功能恢复好的SD/RCS盲鼠上唇提肌内BDNF、FGF2蛋白和mRNA表达的显著增加与突触外TAS减少是共同发生的,遗憾的是,该实验未同时观察NCAM表达的变化。
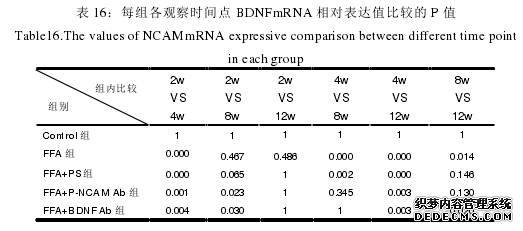

.........
小结
结合以往报道的相关文献、我们前期研究工作及本实验结果,初步明确了以下三个问题,为进一步弄清面神经再生后PEDs形成的机理奠定了基础,同时也为寻找减少PEDs形成的方法提供了新的思路。
一、面神经再生过程中,面肌NCAM的表达经历了由低到高再由高到低的过程,表达变化与面肌由失支配到基本完成再支配的时程相一致。
二、面神经再生过程中,面肌BDNF的表达变化与NCAM的表达变化基本同步。
三、多克隆抗NCAM抗体、抗BDNF抗体可以抑制两者的表达。我们的前期研究工作及本实验结果提示,面神经再生过程中,对面肌NCAM、BNDF表达进行干预有可能减少突触外TAS和PEDs形成,从而提高面神经修复后面肌功能的恢复。
..........
参考文献(略)

