本文是一篇医学论文,医学论文格式由以下6部分组成:论文题目;作者署名、工作单位和邮编;摘要(目的、方法、结果、结论);关健词;正文(资料与方法、结果、结论)参考文献。(以上内容来自百度百科)今天上海论文网为大家推荐一篇医学论文,供大家参考。
前 言
目前,中国人群的主要死亡原因中,恶性肿瘤居于首位,严重威胁人类健康。乳腺癌、子宫颈癌、卵巢癌和肺癌是几种最常见的女性恶性肿瘤[1],其中乳腺癌已经成为女性发病率最高的恶性肿瘤,同时也成为死亡率增长最快的恶性肿瘤。据统计,2012 年的全球乳腺癌新发和死亡病例分别约为 l67 万例和 52 万例,其中我国占全球的比例分别为11.2%和 9.2%,而且这一比例还在迅速增加[2]。乳腺癌是一种具有很强异质性的恶性肿瘤,不同的分子表型具有不同的临床表现和对治疗的不同反应。在临床实践中,通常根据临床特征、腋窝淋巴结转移情况、组织学形态、激素受体表达情况和人表皮生长因子受体 2(HER2)表达状态对乳腺癌患者进行分期和分类[3, 4]。基于受体的表达状态,将乳腺癌分为几种亚型,三阴性乳腺癌(Triple-negative breast cancer, TNBC)属于其中一种特殊类型的亚型,其特征在于不表达雌激素受体(Estrogen receptor, ER)、孕激素受体(Progesterone receptor, PR)和表皮生长因子受体 2(Human epidermal growth factor receptor 2, HER2)。新诊断的乳腺癌患者中,TNBC 患者约占所有患者的 15%左右[3],并且在年轻患者(<50 岁)中更为常见[5, 6]。与其他亚型的乳腺癌相比,TNBC 具有更高的侵袭性,其临床分期更高、更容易复发,而且具有更低的 5 年总生存率[6-8]。目前,乳腺癌的主要治疗措施是外科手术、放疗、化疗、内分泌治疗和分子靶向治疗的综合治疗。因缺少激素受体及 HER2 受体的表达,TNBC 在临床治疗过程中不能应用内分泌治疗及抗 HER2 单克隆抗体治疗。到目前为止,化疗仍然是 TNBC 患者主要的全身治疗手段。针对 TNBC 的多靶点药物仍然处于不同的研究阶段,迄今为止还没有发现有效的靶向治疗手段[9, 10]。放射治疗广泛用于局部乳腺癌的治疗[11, 12],包括 TNBC。同时,放射治疗也是转移性乳腺癌患者主要的局部治疗手段。近年来,随着放射治疗设备的不断改善和放射治疗技术的不断提高,放射治疗的效果有了一定程度的提高[13]。特别是三维适形放疗和调强放疗的不断进步,使得在尽可能保护正常组织不被照射的情况下,显著提高放射治疗的效果[14-17]。即使是通过调强放疗改变照射剂量或者通过三维适形放疗改变照射方法,肿瘤照射野内复发的情况依然存在。放射抗拒的原因是多方面的,除了瘤体中存在乏氧细胞外,放射抗拒还与肿瘤微环境,血管形成,细胞信号转导和DNA 损伤修复等多种肿瘤生物学特征有关[13]。虽然 TNBC 对放射治疗比较敏感,但是部分 TNBC 肿瘤细胞对放射治疗仍然存在抗拒性,因此研究 TNBC 的放疗增敏非常重要。
放射治疗可以引起肿瘤细胞发生多种类型的DNA损伤,包括蛋白质与DNA发生交联、DNA单链断裂(Single-stranded breaks, SSB)、DNA双链断裂(Double-stranded breaks,DSB)、碱基突变等[18]。其中DSB是最重要的致死性损伤。当发生DSB时,受损伤的细胞可以出现染色体的片段化,丢失或重排,从而导致肿瘤细胞死亡。在哺乳动物细胞中,DNA双链断裂主要的修复路径有两条: 同源重组(homologous recombinational,HR)与非同源末端连接(non-homologous end joining,NHEJ)[19]。其中HR是维持基因组完整性的重要机制,依赖于完整模板存在的高度精确形式的DNA修复,修复主要发生在DNA复制后的细胞周期的晚期S和G2期。NHEJ是哺乳动物细胞中的主要修复途径,然而,它是一种固有的不准确的过程,因为两个DNA末端通常没有序列同源性,而是直接连接[20],经常导致DNA断裂位点的核苷酸损失[21]。X线修复交叉互补基因4 (X-ray repair cross complementing protein 4, XRCC4) 是非同源末端连接途径(NHEJ)途径中重要的成员,在NHEJ途径中是专有而且必须的[22, 23]。XRCC4基因定位于5号染色体5q11.2~13.3,该基因表达的蛋白由334个氨基酸残基组成,该蛋白具有的球形N-末端头部结构域,结构域是由七条肽链折叠成喇叭形β桶,然后与长螺旋尾部连接。通过两个头部区域和它们的螺旋尾部的初始部分相关联来进行聚合[24]。在四聚体中,两种XRCC4二聚体通过形成螺旋束相互作用,XRCC4二聚体形成的螺旋束介导其与连接酶IV的相互作用[25]。XRCC4在乳腺癌发生中的作用不是非常明确,目前一些研究发现XRCC4的一些单核苷酸多态性 (SNP) 与对乳腺癌的易感性有关[26,27]。
.........
2.实验方法
2.1 细胞培养
2.1.1 细胞复苏
将 DMEM 培养液(含 10%胎牛血清)在 37℃水浴中预热,在超净工作台中准备两个15ml 离心管,每管中加入 2-3ml 预热后的 DMED 培养液备用。将液氮中的 MDA-MB-231细胞取出,迅速放入 37℃水浴中,轻轻振荡使冻存管,使得细胞悬液在 1-2min 内完全融化。在超净工作台中,将融化后的细胞悬液器转移到含有 2mlDMEM 培养基的离心管中,离心(1000rpm,4min ),弃上清,用 1ml 培养液将细胞重新悬起。将细胞悬液加入含 8-10ml 的 DMEM 培养液(含 10%胎牛血清)的培养皿中,置于 37℃,5%CO2培养箱中。培养液于 1-2 日更换。
2.1.2 细胞传代
若细胞生长状态良好,细胞达到培养皿面积的 70%-90%时进行传代。弃去培养皿中的旧培养液,用 2mlPBS 清洗细胞 2 次,向培养皿中加入含 EDTA 的胰蛋白酶消化液,边摇动边转换方向这样消化液就可以与细胞充分接触,用显微镜观察,当细胞细胞变圆间隙增大时可进行下一步操作。终止消化时向培养皿中加入 3-4ml 含 10%胎牛血清DMEM 培养液,将细胞从培养皿底板上吹下,离心(1000rpm,4min )。按比例 1: 2-4 进行传代,置于 37℃,5%CO2培养箱中。每皿细胞 2-3 日传代一次。
........
2.2 质粒的构建
氨苄青霉素储存液的配制称取 5g Ampicillin 溶于 40mL 去离子水中,充分溶解后,Ampicillin 的浓度即为100mg/mL。在垂直净化工作台中使用 0.22μm 过滤器除菌,分装在 1.5mlEP 管内,每管0.5-1mL,标记名称、浓度及时间后-20℃保存,使用时的终浓度为 100μg/mL。1% 琼脂糖凝胶的配制用精密电子分析天平称 0.25g 琼脂糖,向锥形瓶重加入 1×TAE Buffer 电泳液 25ml,摇动锥形瓶使其混匀,用微波炉中火加热 2-3min,使其完全融化。将完全融化的琼脂糖室温放置,稍冷却后,向其中加入 1μl GoldViewⅠ型核酸染色剂核,轻轻摇动锥形瓶混匀。在电泳板模具中插入选择合适的梳子,将融化后的琼脂糖溶液导入其中,若有气泡,可以用注射器针头将胶中气泡挑出。置于室温,约 30min 后,凝胶就可以凝固。轻轻将梳子拔取,将胶放入核酸电泳槽内,胶孔端朝向负极,加入 1×TAE Buffer 电泳液,电泳液要没过凝胶,便可以上样电泳。
..........
3.结 果 ...... 31
3.1 XRCC4 在 TNBC 患者癌组织和癌旁组织中的表达........... 31
3.2 构建 PLENTI-U6-EF1A-COPGFP-P2A-PURO........... 32
3.2.1 PCR 扩增 copGFP 片段及酶切....... 32
3.2.2 pLenti-U6-EF1a-copGFP-P2A-Puro 阳性克隆筛选和酶切鉴定 ........... 32
3.2.3 pLenti-U6-EF1a-copGFP-P2A-Puro 测序结果 ....... 32
3.2.4 pLenti-U6-EF1a-copGFP-P2A-Puro 功能鉴定 ....... 33
3.3 构建 PLENTI-U6-XRCC4-EF1A-COPGFP-P2A-PURO..... 34
3.3.1 酶切 pLenti-U6-EF1a-copGFP-P2A-Puro ....... 34
3.3.2 pLenti-U6-XRCC4-EF1a-copGFP-P2A-Puro 筛选阳性克隆...... 34
3.3.3 pLenti-U6-XRCC4-EF1a-copGFP-P2A-Puro 测序结果......... 34
3.4 XRCC4 沉默表达 TNBC 稳定细胞系的建立....... 35
3.4.1 慢病毒包装 ...... 35
3.4.2 XRCC4 沉默表达 TNBC 稳定细胞系的建立........ 36
3.4.3 稳定细胞系的鉴定 .......... 38
3.5 XRCC4 基因沉默对 TNBC 细胞增殖的影响....... 39
3.6 XRCC4 基因沉默对 TNBC 细胞放射敏感性的影响........... 39
3.结 果
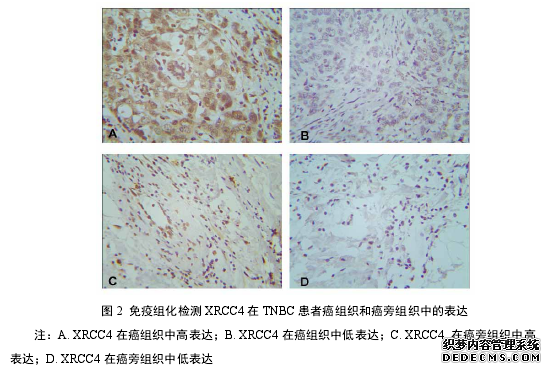
3.1 XRCC4 在 TNBC 患者癌组织和癌旁组织中的表达
选取河南大学淮河医院甲状腺乳腺外科 2011 年 1 月至 2016 年 3 月的 32 例乳腺癌患者作为研究对象,年龄 27~68 岁。根据 AJCC 肿瘤的 TNM 分期,其中Ⅰ期 10 例、Ⅱ期 17 例、Ⅲ期 5 例。所有患者的肿瘤标本均经过病理医师确诊为 TNBC,每例患者均有完整的病理和临床资料。32 例 TNBC 患者的癌组织和癌旁组织经免疫组化检测XRCC4 表达的结果为如表 6 中所示:在癌组织中,11 例 TNBC 患者 XRCC4 呈阳性表达,21 例患者 XRCC4 呈阴性表达,XRCC4 表达阳性率为 34.38%;在癌旁组织中,20例 TNBC 患者 XRCC4 呈阳性表达,12 例患者 XRCC4 呈阴性表达,XRCC4 表达阳性率为 62.50%;XRCC4 在癌组织中的表达阳性率低于癌旁组织中的表达阳性率,两者比较差异具有统计学意义(P<0.05)。其中代表性免疫组化检测结果如图 2 所示。经 PCR 扩增 copGFP 片段后,1%琼脂糖凝胶电泳结果如图 3B 所示。图中泳道 1和 2 可见 750bp 大小的高亮条带,与目的片段 copGFP 大小一致。切胶回收后,用 BamHⅠ和 XbaⅠ酶切,然后用普通 DNA 纯化试剂盒进行酶切产物的纯化,储存于-20℃备用。#p#分页标题#e#

........
综 述
人类 XRCC4 基因定位于 5 号染色体 5q11.2~13.3,该基因表达的蛋白有 334 个氨基酸,该蛋白具有的球形 N-末端头部结构域,结构域是由七条肽链折叠成喇叭形 β 桶,然后与长螺旋尾部连接。分离纯化的 XRCC4 蛋白的生物化学和晶体学分析显示该蛋白质是由两个二聚体聚集成四聚体的状态存在[1]。通过两个头部区域和它们的螺旋尾部的初始部分相关联来进行聚合。在四聚体中,两种 XRCC4 二聚体通过形成螺旋束相互作用[2]。N 末端 250 残基可以使 XRCC4 缺陷型细胞具有电离辐射抗性[3]。一项研究报道,XRCC4 中赖氨酸 210 的 SUMO 化可调节 DSB 修复中的核定位和功能[4]。在 pH 为中性下该蛋白带有负电荷使得 XRCC4 对 DNA 结合较弱,并且 XRCC4 和 DNA 之间的相互作用的分子细节很多都是未知的。但是有研究发现残基 167-200 的缺失可以使 XRCC4蛋白的 DNA 结合活性失活[5]。该区域还含有对其与连接酶的相互作用至关重要的几个保守的碱性残基。因此,该区域可能是形成 XRCC4-DNA 连接酶 IV-DNA 复合物的关键[20]。人类 DNA 连接酶 IV 与其他哺乳动物 DNA 连接酶不同的是,其结构域中特有的是一个大的C端区域,含有串联重复的BRCT域,连接酶IV的C-末端尾负责结合Xrcc4,XRCC4 二聚体形成的螺旋束介导其与连接酶 IV 的相互作用参与 DNA 损伤修复[6]。在哺乳动物细胞中,DSB 主要的修复途径有两条: 同源重组 (homologousrecombinational,HR)与非同源末端连接(non-homologous end joining,NHEJ) 。NHEJ 是修复人细胞和多细胞真核生物中双链 DNA 断裂的主要途径,主要维持基因组的稳定性[7]。在 NHEJ 修复途径中重要的成员 XRCC4 基因参与 DNA DSB 修复和 V(D)J 重组[8]。近几年有研究报道 XRCC4 样因子/ Cernunnos(XLF / Cer)能与 XRCC4 的相互作用合[9-11]。 DSB 诱导后,XLF / Cer 通过 XRCC4-DNA 连接酶复合物能够激活互补和非互补 DNA 末端的连接[12]。 XRCC4 是哺乳动物成纤维细胞所需的非精确末端连接修复DNA DSBs[13]。在基因靶向突变小鼠模型中,XRCC4 基因失活导致晚期胚胎致死并伴有缺陷淋巴发生和缺陷性神经发生[14]。
..........
参考文献(略)

