药学论文哪里有?本研究成功制备具有 pH 肿瘤靶向性的可有效递送核酸基因的PLGA-(HE)10-MAP 纳米粒。但本研究仅进行了体外实验部分,仅是对基因治疗肿瘤的新型药物递送系统开发的初步探索,将在后续实验中完善纳米粒的体内实验与评价,以期为进一步研发及临床应用提供依据。
1 材料和方法
1.2 实验方法
1.2.1 制备 PTEN/PLGA-(HE)10-MAP 纳米粒
采用双乳化-溶剂挥发(W/O/W)法[15]制备载基因 PLGA 纳米粒:一定质量的质粒 DNA 溶于 200 μL TE-buffer (pH 8.0)作为 W1 相;DOTAP 与 PLGA 的质量比为1:5,将 50 mg PLGA 与 10 mg DOTAP 溶解于 1 mL 二氯甲烷(Dichloromethane,DCM)中作为 O 相;2% (w/v) PVA 水溶液 3 mL 作为 W2 相。空载 PLGA 纳米粒以 200 μL 不含质粒 DNA 的无菌去离子水作为 W1 相。在冰浴条件下,将 W1 相轻缓滴加入 O 相,同时用超声波细胞粉碎机超声乳化 2 min,功率 55 W,超声 1 s暂停 2 s,振幅 35%,形成 W/O 型初乳溶液。沿管壁向该乳液中缓慢加入 W2 相,以相同条件继续冰浴超声 2 min 形成 W/O/W 型复乳溶液,将得到的复乳逐滴加入8 mL 1% (w/v) PVA 水溶液中,常温下恒速磁力搅拌(500 r/min) 4 h 以挥发除去有机溶剂。通过低温高速离心(4 ℃, 18000 ×g, 15 min)收集纳米粒,继而用适量无菌去离子水重悬洗涤 3 次后得到载基因 PLGA 纳米粒混悬液。于-80 ℃放置至完全冷冻,置于真空冷冻干燥机进行干燥并称重。参考相关文献[16],通过酰胺缩合反应,制备 pH 响应性细胞穿膜肽修饰的 PLGA 纳米粒:取 2 mL 纳米粒混悬液,于磁力搅拌器上,首先室温条件下加入 0.91 mg EDC 低速搅拌 10 min 后,加入 1.09mg NHS 避光搅拌 30 min,活化羧基基团;继而冰浴条件下加入过量的 MAP 或(HE)10-MAP,避光低速搅拌过夜,使 PLGA 的羧基端与肽的氨基端脱水偶联;4 ℃、18000 ×g 离心 15 min,弃上清,洗涤 3 次以去除未结合的肽,适量无菌去离子水重悬,置于 4 ℃储备待用。

2 结果
2.1 表征 PTEN/PLGA-(HE)10-MAP
2.1.1 粒径及多分散系数
经扫描电镜观察到制备的 PTEN/PLGA-(HE)10-MAP 纳米粒呈大小较均一、表面较光滑的球形。采用动态光散射法检测载基因纳米粒的粒径分布如图 2 所示。纳米粒的平均粒径为(266.5±2.86) nm,尺寸与电镜图结果相似。粒径分布符合良好的正态分布模式,提示分布较为均匀,无大颗粒杂质和团聚现象。多分散系数(Polydispersity index, PDI)平均值为 0.231±0.01,小于 0.3,表明粒径分布集中均一。
2.1.2 Zeta 电位
在药物递送系统相关文献中,多依据 zeta 电位值,按照±(0-10) mV、±(10-20)mV、±(20-30) mV 和˃±30 mV 将分散体系定义为高度不稳定、相对稳定、中等稳定和高度稳定[17]。当电位值大于+50 mV 时,纳米粒将表现出明显的细胞毒性。采用电泳光散射法测定载基因纳米粒的 Zeta 电位,分布结果如图 3 所示。在 pH 7.4、pH 7.0 和 pH 6.5 条件下纳米粒的 Zeta 电位分别为-(6.7±0.26) mV、+(0.7±0.22) mV和+(37.5±0.85) mV,随 pH 值的降低,Zeta 电位由负逐步转为正,表明制备的纳米粒在弱酸性环境中稳定,且在一定 pH 范围具有 pH 敏感性。
2.2 PLGA-(HE)10-MAP 具有较低的细胞毒性
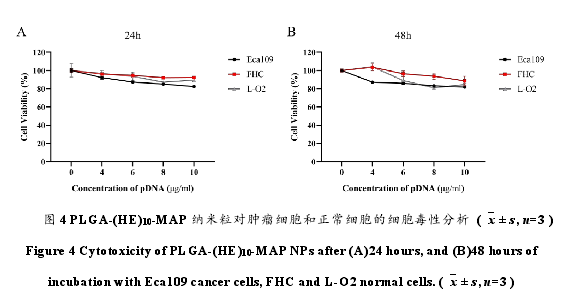
通过 CCK-8 实验检测不同浓度非载基因 PLGA-(HE)10-MAP 纳米粒(卸载不同浓度质粒所需的纳米粒)对肿瘤细胞 Eca109 和正常组织细胞 FHC、L-O2 的体外细胞毒性。如图 4 所示,同对照组相比,虽然部分浓度组非载基因纳米粒致使细胞存活率有所降低,但各浓度组在不同作用时间下的细胞存活率均在 80%以上,即细胞的生长状态和数量未受明显影响。表明制备的纳米粒细胞毒性较低,生物相容性良好。
3 讨论
恶性肿瘤是目前仅次于心血管疾病的全球第二大死亡原因,其发生与多种基因的改变和疾病有关[19]。临床最常用的癌症治疗措施主要为手术治疗、放疗和化疗等传统疗法,但存在疗效不佳、预后不佳、易对正常组织细胞造成损伤、易复发等问题[20]。随着基因工程技术的不断发展,基因治疗由早期主要用于单基因遗传性疾病的治疗,扩展到用于恶性肿瘤、感染性疾病、心血管疾病等重大疾病的治疗[21]。截至 2017 年底,全球已完成、正在进行或已批准基因治疗临床试验方案共计约 2600 项,其中 2/3 为针对各种恶性肿瘤的项目[22]。“重组腺病毒-p53 抗癌注射液”(商品名 Gendicine)作为首个上市的基因治疗药物,即是针对恶性肿瘤治疗的产品,显示出基因治疗在癌症治疗中的应用潜力。抑癌基因 PTEN 的蛋白表达降低、缺失或磷酸化与多种恶性肿瘤的发生、进展、预后有着密切的相关性,具有广泛的应用前景[18]。然而,由于核酸的高阴离子电荷密度、大小以及亲水性特征,质粒 DNA 本身难以被动扩散跨膜运输[23]。设计构建安全、高效和可控的体内基因递送系统成为肿瘤基因治疗的关键步骤。
基因药物递送系统主要包括病毒载体与非病毒载体两类。非病毒载体制备方法更为简便多样,免疫原性更低,无插入诱变的风险,安全性更高,使用限制更小,是基因治疗中常用的递送载体[24]。其中,生物可降解型聚合物 PLGA 具有良好的生物相容性、生物可降解性和可塑可修饰性,PLGA 纳米粒携带药物以内吞作用通过细胞膜,可防止药物降解、降低药物毒性并减少刺激[10, 25]。本研究选用PLGA 作为载体材料,使用带正电荷的阳离子化合物 DOTAP 形成反胶束修饰PLGA,与带负电荷的质粒 DNA 相互作用, 采用针对亲水性药物最常用的双乳化-溶剂挥发(W/O/W)法,实现质粒 DNA 在水核内的有效包封[26]。且由于 DOTAP的修饰,纳米粒带正电荷。本研究制备的纳米粒粒径位于 200-300 nm 之间,粒径适宜且在弱酸性条件下带正电荷,能很好地被肿瘤细胞摄取[27, 28]。包封率在 80%以上,符合《中国药典》相关指导原则。
全文总结
1.成功制备并表征 pH 响应的肿瘤靶向 PTEN/PLGA-(HE)10-MAP 纳米粒。
2. 制备的 PTEN/PLGA-(HE)10-MAP 纳米粒可被细胞摄取表达,且具有 pH 靶向抑制肿瘤细胞增殖的作用,在肿瘤的基因治疗中具有一定的应用前景。
参考文献(略)

