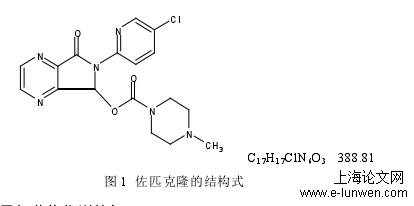
本文是药学论文,本文对佐匹克隆的关键理化特性进行系统性研究,通过建立佐匹克隆原料及片剂的 HPLC 检测方法测定溶解度,得知佐匹克隆是一个高溶解性药物;相关渗透性研究表明其具有高渗透性,依据药物的 BCS 分类表明佐匹克隆为 BCSⅠ类药物。三个国内企业的原料药晶型一致且具有相同的固有溶出速率,可见药物的溶出行为与原料药的制备工艺无关,而是与制剂的生产工艺相关。进一步对国内外佐匹克隆片剂的关键质量参数进行了系统的比对。对国内现行的溶出度检测方法进行优化,对比 3 个国内企业与原研企业制剂溶出度。企业 B 与原研企业制剂的溶出行为相似程度最大,另外两个企业的相似程度低,需进一步改善制剂的处方工艺。有关物质研究表明原研佐匹克隆片的杂质种类少,单杂及总杂含量均低于国内企业,产品质量优于国内制剂。国内制剂均需进行一定程度的制剂工艺控制,确保制剂工艺的稳定性并将有关物质控制在合理的范围内。
......
第一章 前言
新药研发是一个艰难而又冗长的过程,伴随着大量的人力物力投入以及未知的风险因素。当新药专利到期的浪潮来临时,大部分长期觊觎的企业进行仿制药的研发和上市,将投资的成本降到最低,以获得较高的利润。我国是一个人口基数过大的国家,面临着医疗卫生保障的巨大压力,仿制药无疑是全社会的一笔巨大财富。国家在大力支持新型仿制药研发进程时,对于仿制药质量的参差不齐,也在加强对仿制药质量和疗效的管控。为确保人民用药安全,提高医药行业的国际竞争力,使国产药品质量达至国际先进水平,原国家食品药品监督管理总局要求在 2018 年底完成 289 目录中药物的一致性评估[12]。仿制药的等效性主要从两方面进行评估,一是药物的关键质量属性,即药学一致性;二是体的生物等效性,即疗效一致性[12]。药品的生物等效性试验是测定仿制药是否与原研药药效一致的最标准的方法。但是对于不易进行体内试验的药品,体外溶出实验是一种快捷简单的替代方式。药品的溶出行为可以反映出不同制剂工艺间的差异,并且体外溶出曲线存在差异的制剂,其药物在体内的吸收与释放很可能也会存在区别。因此,药物的溶出行为在药品质量评估过程被予以高度关注。

......
第二章 佐匹克隆原料药重要理化性质研究
第一节 佐匹克隆原料药固有溶出测定
药物的固有溶出速率用于描述药物固体表面到液相的质量传递速率特性,是一种速率特征而非平衡现象。相比溶出度,它与药物在体内的溶出速率存在一定的相关性,可用于评价原料药批次间、不同来源、不同晶型的一致性,亦是判断药物 BCS 分类的重要依据之一[14]。依据 USP41 版中<1087>指导原则,对佐匹克隆原料药的固有溶出速率进行测量,筛选出适合的固有溶出速率测定条件。比较原研与仿制原料药的固有溶出速率是否存在差异,为佐匹克隆片剂的溶出行为差异提供支持。
第二节 佐匹克隆原料药晶型考察
不同企业佐匹克隆粉末 X 射线扫描结果如图 14 所示。由实验结果可知,四个厂家的佐匹克隆晶型均为同一晶型,尽管在峰强和峰面积上有略微的区别,在关键的°2θ值(5.0、10.0、14.9、16.0、17.9、21.3、25.6、27.6、29.7)处均存在明显的衍射峰。对比结果可以确定 4 个企业生产的佐匹克隆料药晶型应为无水非中心对称的正交晶型化合物。该结果反应出不同生产厂家的原料药虽然合成工艺存差异,其原料药的晶型均保持一致,且对于制剂的溶出行为无明显影响。口服药物在胃肠道体液的溶解度对后续透过脂质双分子层进入血循环这一吸收过程影响重大。了解药物的水溶性和脂溶性可以用于预判药物的 BCS 分类,对于评价药物在人体内的吸收、药效作用意义深远。本节测定佐匹克隆的在不同介质下的平衡溶解度及表观油水分配系数,为药物制剂研究开发及改善药品的生物利用度提供数据基础[17]。
.......
第三章 佐匹克隆片剂关键质量属性研究................................................................45
第一节 佐匹克隆片剂溶出度性质比较.............................................................46
第二节 佐匹克隆片剂有关物质研究.................................................................53
第三节 主要杂质的毒性研究.................................................................................65
第四章 利用计算机软件模拟佐匹克隆片的虚拟生物等效性...............................78
第五章 总结.................84
.......
第四章 利用计算机软件模拟匹克隆片的虚拟生物等效性
第一节房室模型的搭建与验证
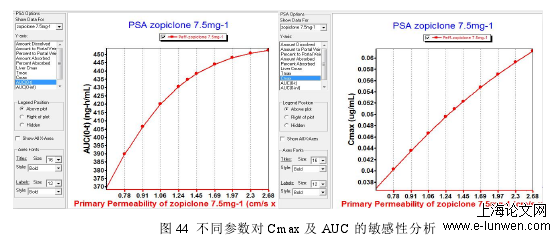
对于缺失的相关制剂学参数(沉降时间、扩散系数、粒子密度、离子半径)进行参数敏感性分析,确定其对体内吸收行为是否有影响,结果如图 44 所示。结果表明,相关缺失的制剂学参数对于体内的吸收行为(主要为 Cmax 和 AUC)并没有明显影响,因此,建模使用的 Gastroplus 的默认值作为相关缺失参数的数值。将原研企业的 7.5mg 静脉注射数据输入 PK Plus 模块,计算出佐匹克隆体内吸收适用的最佳房室模型以及清除率和相关参数。结果表明佐匹克隆适用于二房室模型,这与相关文献报道的结果一致,因此本文采用二室模型作为研究的处置模型。将向清除率及其他基本参数加载至软件中,通过药物的理化参数及内置的 ACAT 的胃肠道模型模拟 7.5mg 静脉注射制剂的药物体内行为。结果表明实测数据与模拟出的药时曲线有良好的吻合性,如图 45 所示。

第二节选择与药物体内吸收相关的溶出介质
通过加载原研企业 7.5mg 剂量不同介质下的溶出曲线,通过内置的 ACAT的模型及相关药代动力学参数,可模拟药物在体内的释放与吸收,寻找与药物体内释放最相关的溶出介质。如图 46 所示,当体外溶出介质为 p H1.0、p H4.0 的条件下,药物的体外溶出行为所模拟的体内药时曲线与原研同剂量下的实测数据的拟合性较好。而溶出介质为 p H6.8 和水时,模拟的体内释放曲线与实测数据相差相对较大。因此采用与体内溶出行为最为相关溶出介质作为筛选条件,模拟原研企业与仿制药企业同规格片剂的虚拟生物等效性。除可自证生物等效性豁免的药物,其余仿制药进行申请上市前都需要验证仿制药物与原研药物在人体内的生物等效性。生物等效性研究一般为探讨受试制剂与参比制剂在人体内吸收的速度与程度是否在可控的范围内,主要适用于化学药品的上市申请及工艺变更申请。
.........
第五章 总结与展望
通过斑马鱼体外胚胎毒性研究表明佐匹克隆及四个已知杂质的胚胎发育毒性为:杂质 C >2-氨基-5-氯吡啶≥杂质 B >杂质 A >佐匹克隆。主要降解杂质 2-氨基-5-氯吡啶及杂质 B 尚未检测到基因致突变性。由于 2-氨基-5-氯吡啶为主要降解杂质且毒性相对较强,建议单独控制并制定科学合理的控制限度。使用 Gastroplus 软件建立佐匹克隆体外溶出与体内释放吸收的模型,利用Johnson 模型筛选出与体内释放相关的体外溶出介质,通过虚拟 BE 实验考察了国内企业与原研企业的生物等效性。三家国内企业与原研企业可能存在一定的生物等效性关系,该结果为后续开展生物等效性实验提供一定的参考。佐匹克隆原料药氧化破坏后的样品产生的两个未知杂质,需通过质谱裂解对其进一步的定性研究。虽然原研与 B 企业制剂工艺不同,但溶出行为相似程度最大且辅料中都含有磷酸氢钙,应进一步探讨磷酸氢钙对制剂的溶出行为是否有影响。国内外溶出度对比研究中研究表明现行药典中佐匹克隆含量测定方法及有关物质测定方法皆存在不合理现象,望后续可得到优化更新。研究表明现行药典中佐匹克隆含量测定方法及有关物质测定方法皆存在不合理现象,望后续可得到优化更新。最后应结合处方工艺及改进工艺后的样品可对药物一致性评价进行更全面完善系统的研究。
参考文献(略)

