第一章 绪论
1.1 引言
活性氧(Reactive oxygen species,ROS),是指经过氧分子单电子还原生成一些代谢物及衍生物,其中包括如O2-、?OH等自由基物质和H2O2、1O2等非自由基物质等(师瑞红等,2005)。植物进行有氧代谢时,产生大量ROS会导致脂类、蛋白、核酸等一些生物大分子发生氧化反应,从而影响植物正常的生长发育(李武,2010)。同时,H2O2(过氧化氢)作为一种重要信号分子,参与植物对生物和非生物胁迫响应,提高植物对外界逆境胁迫的适应性(Neill,2002)。
1.1 引言
活性氧(Reactive oxygen species,ROS),是指经过氧分子单电子还原生成一些代谢物及衍生物,其中包括如O2-、?OH等自由基物质和H2O2、1O2等非自由基物质等(师瑞红等,2005)。植物进行有氧代谢时,产生大量ROS会导致脂类、蛋白、核酸等一些生物大分子发生氧化反应,从而影响植物正常的生长发育(李武,2010)。同时,H2O2(过氧化氢)作为一种重要信号分子,参与植物对生物和非生物胁迫响应,提高植物对外界逆境胁迫的适应性(Neill,2002)。
种子萌发是植物生命周期中最关键的阶段,影响着植物生长和生产力。植物种子在正常发育和贮藏中,其自身的有氧代谢导致产生活性氧,活性氧过量积累可损伤种子活力(Yin,2014)。H2O2作为影响植物体内活性氧平衡的主要物质,其含量的高低与种子活力密切相关(Xia,2015)。高浓度H2O2外源处理,可能会引起种子中营养物质的外渗、改变种子萌发过程中的代谢途径,从而会抑制种子萌发(何士敏等,2008)。H2O2被认为是重要的种子发芽促进剂,研究发现,添加适宜浓度H2O2,可打破大豆(Glycine max)和小麦(Triticum aestivum)种子的休眠,促进其萌发(He,2007;Zhang,1996);可提高木豆(Cajanus cajan)、油桐(Vernicia fordii )种子萌发过程中的抗旱和耐盐性(Ellouzi H,2017)。目前,外源H2O2处理对种子萌发的影响已在水稻(Oryza sativa)(Tan,1991)、大豆(何士敏等,2008)、小麦(Zhang,1996)等植物中有研究报道。外源H2O2对种子萌发的处理结果,是否受植物品类的影响,其作用机理仍有待进一步研究。
与油料作物油菜种子相比,白沙蒿(Artemisia sphaerocephala)种子在老化处理后受到的损伤更小,能更好的维持种子活力,比油菜种子更耐老化(张艳慧,2016);储藏过程中白沙蒿种子脂质过氧化程度较小,是其耐储藏的重要原因之一(段国琴,2018)。目前,白沙蒿种子活力与其H2O2含量的关系研究较少,因此,本试验以2018年采集白沙蒿种子为试验材料,探究外源H2O2添加与清除后,对白沙蒿种子萌发特性、生理变化的影响,对不同种类植物种子外源添加H2O2处理后,种子的萌发规律进一步加深理解,为系统地解释白沙蒿种子的萌发与H2O2之间的关系作进一步的研究。
与油料作物油菜种子相比,白沙蒿(Artemisia sphaerocephala)种子在老化处理后受到的损伤更小,能更好的维持种子活力,比油菜种子更耐老化(张艳慧,2016);储藏过程中白沙蒿种子脂质过氧化程度较小,是其耐储藏的重要原因之一(段国琴,2018)。目前,白沙蒿种子活力与其H2O2含量的关系研究较少,因此,本试验以2018年采集白沙蒿种子为试验材料,探究外源H2O2添加与清除后,对白沙蒿种子萌发特性、生理变化的影响,对不同种类植物种子外源添加H2O2处理后,种子的萌发规律进一步加深理解,为系统地解释白沙蒿种子的萌发与H2O2之间的关系作进一步的研究。
.............................
1.2 文献综述
1.2.1 活性氧
1.2 文献综述
1.2.1 活性氧
植物有氧代谢中部分氧气(O2)受氧化还原反应的影响,产生了活性较强的ROS,其中包括过氧化氢(H2O2)、超氧阴离子(O2-)和羟自由基(·OH)以及一氧化氮(NO)等。O2接受电子传递,形成O2-,植物在正常环境下,通过电子转移、光合作用等产生少量的O2(Halliwell and Gutteridge,1989;刘树森,2005)。O2-除了能自身歧化为H2O2,也能通过SOD的催化歧化产生H2O2(赵丽英等,2005)。H2O2为中性时,更具有稳定性,但因为其具有成对的电子,可以穿透生物质膜,对植物产生伤害(Halliwell and Gutteridge,1989)。所以,当H2O2的浓度较低时,其可作为ROS的信号传导分子,对生物特定的过程进行调控,或者当植物遭受到外界逆境胁迫时,可以参与介导,使植物对外界环境形成抗逆性(Neill and Desikan,2002)。而当H2O2的浓度较高时,植物中的半胱氨酸和甲硫氨酸的含硫基团可以被H2O2氧化,使植物在反应过程中一些酶失活。同时,H2O2也能氧化植物中的磷酸酶、蛋白激酶含硫醇基的转录因子,可以诱发植物细胞程序的进一步死亡(Moller et al.,2007;Kaiser,1979)。
过氧化氢酶(CAT)主要存在于细胞内的氧化物中,对H2O2的清除起重要作用,对H2O2的亲和性低,虽清除速度快,但对H2O2的作用有限。不过,对H2O2的亲和性高的,如APX等(林文洁和陈丽晖,1998)。此外,H2O2也能作为POD(过氧化物酶)的底物,其与O2ˉ反应形成·OH,而被清除(Haber-Weiss反应Halliwell and Gutteridge,1989)。而·OH是ROS中活性最高的,可以氧化植物中的多数物质分子,造成植物细胞的膜脂过氧化以及损伤蛋白等细胞。但是,植物细胞内清除·OH的酶促反应较为缺乏,因此,·OH的逐渐积累也可以造成植物细胞的损伤(苏立强,2016)。

..........................
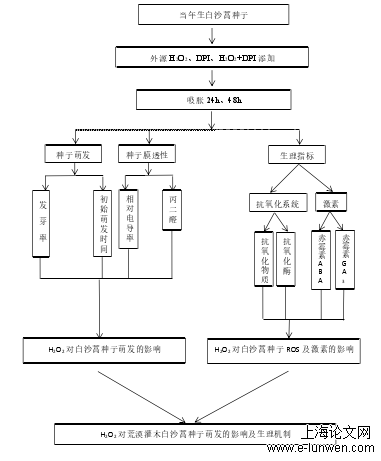
第二章 材料与方法
2.1试验处理
选择 H2O2 作为外源 ROS 供体,二苯基氯化碘盐(diphenyleneiodoniumchloride, DPI)作为抗氧化剂,清除内源性 H2O2。H2O2 工作液浓度分别配置为1 mmol/L、5 mmol/L、10 mmol/L、30 mmol/L、50 mmol/L、70 mmol/L、100mmol/L,DPI 工作液浓度分别配置为 10 μmol/L、25 μmol/L、100 μmol/L,以H2O 对照, 25℃下进行萌发实验。萌发过程中,每天将萌发进程中的种子转移至新鲜 H2O、相应浓度 H2O2 和 DPI 侵泡的滤纸上。萌发持续 7d,每天统计发芽数、计算发芽率,筛选外源添加 H2O2、DPI 最适浓度。后续实验在最佳处理浓度下,分别收集 24 h 和 48 h 后的吸胀未萌发种子,液氮速冻后,保存于-20℃冰箱用于相关指标的测定。
第二章 材料与方法
2.1试验处理
选择 H2O2 作为外源 ROS 供体,二苯基氯化碘盐(diphenyleneiodoniumchloride, DPI)作为抗氧化剂,清除内源性 H2O2。H2O2 工作液浓度分别配置为1 mmol/L、5 mmol/L、10 mmol/L、30 mmol/L、50 mmol/L、70 mmol/L、100mmol/L,DPI 工作液浓度分别配置为 10 μmol/L、25 μmol/L、100 μmol/L,以H2O 对照, 25℃下进行萌发实验。萌发过程中,每天将萌发进程中的种子转移至新鲜 H2O、相应浓度 H2O2 和 DPI 侵泡的滤纸上。萌发持续 7d,每天统计发芽数、计算发芽率,筛选外源添加 H2O2、DPI 最适浓度。后续实验在最佳处理浓度下,分别收集 24 h 和 48 h 后的吸胀未萌发种子,液氮速冻后,保存于-20℃冰箱用于相关指标的测定。
....................
2.2测定项目与方法
2.2.1种子萌发相关指标的测定
参照白沙蒿种子萌发标准(于浩然等, 1994; 黄振英等, 2001),采用培养皿纸上法,在 25℃光照培养箱(MLR-351H, Panasonic)中进行发芽实验。每皿随机 50 粒种子,设置 5 次重复。胚根突破种皮视为萌发,每 24 h 计数一次、计算发芽率,统计持续 7 天。同时观察并记录每个培养皿中第一粒种子萌发的天数,记为初始萌发时间。
发芽率(%)= 已萌发种子数/种子总数×100%;
2.2测定项目与方法
2.2.1种子萌发相关指标的测定
参照白沙蒿种子萌发标准(于浩然等, 1994; 黄振英等, 2001),采用培养皿纸上法,在 25℃光照培养箱(MLR-351H, Panasonic)中进行发芽实验。每皿随机 50 粒种子,设置 5 次重复。胚根突破种皮视为萌发,每 24 h 计数一次、计算发芽率,统计持续 7 天。同时观察并记录每个培养皿中第一粒种子萌发的天数,记为初始萌发时间。
发芽率(%)= 已萌发种子数/种子总数×100%;
.2.2种子相对电导率和丙二醛含量的测定
相对电导率:采用浸泡法(Diao et al., 2014)。种子清洗后,放置于试管中,加去离子水,在室温下浸泡 12h。用电导率仪测定,电导率 R1(沸水浴前),30 分钟后,冷却,测定电导率 R2,计算电导率。
MDA 含量:TBA 法(苍晶等, 2013)。称取 0.5g 种子至于研钵内,加入10 mL 10%(v/v)TCA 溶液,用石英砂研磨成匀浆,4000 rpm 下离心 10 min,吸取上清液进行测定。在试管中分别加入上清液、0.6%(w/v)TBA 各 2 mL,混匀,沸水浴中反应 15 min,冷却后离心,取上清液测定 450 nm、532 nm 及600 nm 下的 OD 值。
相对电导率:采用浸泡法(Diao et al., 2014)。种子清洗后,放置于试管中,加去离子水,在室温下浸泡 12h。用电导率仪测定,电导率 R1(沸水浴前),30 分钟后,冷却,测定电导率 R2,计算电导率。
MDA 含量:TBA 法(苍晶等, 2013)。称取 0.5g 种子至于研钵内,加入10 mL 10%(v/v)TCA 溶液,用石英砂研磨成匀浆,4000 rpm 下离心 10 min,吸取上清液进行测定。在试管中分别加入上清液、0.6%(w/v)TBA 各 2 mL,混匀,沸水浴中反应 15 min,冷却后离心,取上清液测定 450 nm、532 nm 及600 nm 下的 OD 值。
.........................
第三章 结果与分析.............................. 17
3.1 添加 H2O2、DPI 最适浓度的筛选....................................17
3.2 添加 H2O2、DPI 后对种子发芽率的影响.................................18
3.3 添加 H2O2、DPI 后对白沙蒿种子细胞膜透性的影响..................................20
第四章 讨论.....................................30
4.1 添加 H2O2、DPI 后对白沙蒿种子萌发的影响..........................30
4.2 添加 H2O2、DPI 对白沙蒿种子膜透性的影响...............................30
第五章 结论与展望............................. 36
5.1 主要结论....................................36
5.2 展望.......................................36
第四章 讨论
4.1 添加H2O2、DPI后对白沙蒿种子萌发的影响
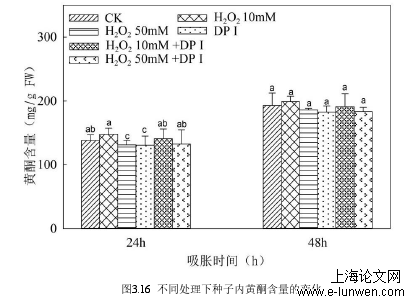
种子萌发阶段,是植物生命周期中最重要的阶段之一。种子萌发的有效进行决定了幼苗的正常发育和生长。对植物种子来说,发芽是一个非常复杂的过程,从吸水开始,涉及到静止干燥种子向代谢活性状态的转变。胚胎的出现被认为是种子发芽的最后阶段(Weitbrecht et al .,2011;Bewley et al.,2013)。种子活力是种子特性的综合表现,种子活力的高低,决定了种子在萌发过程中的活性水平(杜利霞等, 2005; El-Keblawy and Al-Rawai, 2006),而发芽率是表示种子活力的重要指标 (Pukacka et al., 2007)。目前研究发现,低浓度H2O2处理促进谷类植物种子萌发,但高浓度H2O2限制谷类植物种子萌发,如水稻(Oryza sativa L)(王艳玲,2017)、小麦(卢金,2012)和玉米(Zea mays L)(张秀英,2009)的种子。本研究中,低、高浓度H2O2对白沙蒿种子萌发的作用与其他物种有所差异:低浓度H2O2添加下,白沙蒿种子发芽率为31.6%,显著低于对照,说明低浓度H2O2对白沙蒿种子的萌发有一定的抑制作用,同时加入DPI后,发芽率为36.00%,低于对照,与单纯添加低浓度H2O2相比并无显著差异,但显著高于单纯添加DPI时的发芽率,说明H2O2复合DPI处理下,白沙蒿种子的萌发与对照相比依然受到抑制,但逆转了单独添加DPI对种子发芽率的抑制作用,高浓度H2O2处理下,白沙蒿种子发芽率为78.40%,显著高于对照,说明高浓度H2O2添加下,白沙蒿种子的萌发得到促进。但同时加入DPI后,发芽率显著下降,与单纯添加H2O2相比,高浓度H2O2对种子发芽率促进的趋势被逆转,但也同样解除了单独添加DPI对种子发芽率的抑制作用;而对白沙蒿种子单独添加DPI后,白沙蒿种子的发芽率为21.20%,且发芽率随DPI浓度的增加而降低,种子的萌发特性发生改变 ,说明DPI能够抑制白沙蒿种子的萌发。#p#分页标题#e#
..............................

..............................
第五章 结论与展望
5.1 主要结论
(1)白沙蒿种子萌发受 H2O2 浓度的调控:低浓度 H2O2 抑制,高浓度 H2O2促进;DPI 清除内源 H2O2 显著抑制白沙蒿种子萌发,H2O2 复合 DPI 处理下,白沙蒿种子萌发率低于对照,表明内源性 H2O2 对其萌发过程具有重要作用。
(2)低浓度 H2O2 处理下,ABA 含量上升,GA3 含量下降,GA3/ABA 比值降低抑制种子萌发;高浓度 H2O2 处理下,ABA 含量下降,GA3 含量上升,GA33/ABA 比值升高促进种子萌发。
(3)低浓度 H2O2 处理下,白沙蒿种子 SOD、CAT、APX、GR 酶活性以及 AsA、GSH 抗氧化物质含量上升,H2O2 被清除,抑制种子萌发;高浓度 H2O2下,其抗氧化能力下降造成 H2O2 积累,促进了种子萌发。
5.1 主要结论
(1)白沙蒿种子萌发受 H2O2 浓度的调控:低浓度 H2O2 抑制,高浓度 H2O2促进;DPI 清除内源 H2O2 显著抑制白沙蒿种子萌发,H2O2 复合 DPI 处理下,白沙蒿种子萌发率低于对照,表明内源性 H2O2 对其萌发过程具有重要作用。
(2)低浓度 H2O2 处理下,ABA 含量上升,GA3 含量下降,GA3/ABA 比值降低抑制种子萌发;高浓度 H2O2 处理下,ABA 含量下降,GA3 含量上升,GA33/ABA 比值升高促进种子萌发。
(3)低浓度 H2O2 处理下,白沙蒿种子 SOD、CAT、APX、GR 酶活性以及 AsA、GSH 抗氧化物质含量上升,H2O2 被清除,抑制种子萌发;高浓度 H2O2下,其抗氧化能力下降造成 H2O2 积累,促进了种子萌发。
本文对外源添加 H2O2、DPI 的白沙蒿种子萌发变化、种子活力、生理变化、生化变化进行了研究,并探讨了外源添加对白沙蒿萌发的生态意义,但以下几个方面还有待进一步的研究和探讨:
(1)白沙蒿种子表面有一层不同于其他植物的粘液物质,在外源添加萌发过程中萌发特性的改变是否与这层粘液物质有关还需要更进一步的验证。
(2)对白沙蒿种子进行 H2O2、DPI 外源添加后,表现出了不同的萌发特性,是由于作为荒漠植物适应环境的特殊性引起的,萌发可能受 ROS 和激素信号通路之间的相互作用影响,本研究只做了一些初步探索,这两者对种子萌发特性的影响还需从更多的生理和分子方面进行更深入的研究来进一步确定。
参考文献(略)
(1)白沙蒿种子表面有一层不同于其他植物的粘液物质,在外源添加萌发过程中萌发特性的改变是否与这层粘液物质有关还需要更进一步的验证。
(2)对白沙蒿种子进行 H2O2、DPI 外源添加后,表现出了不同的萌发特性,是由于作为荒漠植物适应环境的特殊性引起的,萌发可能受 ROS 和激素信号通路之间的相互作用影响,本研究只做了一些初步探索,这两者对种子萌发特性的影响还需从更多的生理和分子方面进行更深入的研究来进一步确定。
参考文献(略)

