
第一章 文献综述
1.1 副溶血性弧菌与水产安全
1.1.1 副溶血性弧菌的生物学特征
副溶血性弧菌(Vibrio Parahemolyticus)也称作称副溶血弧菌,是一类有运动性的革兰氏阴性细菌,无芽孢、兼性厌氧、具鞭毛,可呈多种形状,如棒状、弧状、卵圆状等。其首次被发现是 1950 年日本学者从日本大阪一名咸沙丁鱼食物中毒的患者肠道排泄物中分离而来;此后,在美国、中国、印度等多个国家均有产生报道,1966 年国际弧菌命名委员会正式命名为副溶血弧菌。
副溶血弧菌在 TCBS 平板(硫代硫酸钠-柠檬酸盐-胆盐-蔗糖)上会形成表面光滑、湿润的绿色圆形菌落,在普通琼脂中呈乳白色、直径为 2~3mm 的圆形小菌落。该菌对营养的要求低,在碱性蛋白胨水中培养时培养液上表面容易形成一层白色菌膜。该菌嗜盐,研究显示其在盐度 3%-6%的环境中生长良好,而当盐度高于 10%或无盐时则完全不生长;VP 的生长温度为 15~44℃,最适生长温度为 35~37℃,在 72h时生长最旺盛[1],其在环境中的分布季节性明显,夏秋季是高发季节,同时对低温也有较好的耐受性,-70℃冻干状态下保存三月仍有 83%菌株为失活,但对高温抵抗力小,65℃环境下处理 5min 即会死亡,故通常采取-70℃冻干法进行保存[2];适宜生长的 p H 区间为 7.0-9.0,其中 pH7.7 最佳,在碱性环境下更易生存,对酸性环境是极度敏感[3],pH6 以下便不能生长。大多生存于内海岸的海水及海水淤积物和鱼、贝类等渔产品中 [4]。
1.1.1 副溶血性弧菌的生物学特征
副溶血性弧菌(Vibrio Parahemolyticus)也称作称副溶血弧菌,是一类有运动性的革兰氏阴性细菌,无芽孢、兼性厌氧、具鞭毛,可呈多种形状,如棒状、弧状、卵圆状等。其首次被发现是 1950 年日本学者从日本大阪一名咸沙丁鱼食物中毒的患者肠道排泄物中分离而来;此后,在美国、中国、印度等多个国家均有产生报道,1966 年国际弧菌命名委员会正式命名为副溶血弧菌。
副溶血弧菌在 TCBS 平板(硫代硫酸钠-柠檬酸盐-胆盐-蔗糖)上会形成表面光滑、湿润的绿色圆形菌落,在普通琼脂中呈乳白色、直径为 2~3mm 的圆形小菌落。该菌对营养的要求低,在碱性蛋白胨水中培养时培养液上表面容易形成一层白色菌膜。该菌嗜盐,研究显示其在盐度 3%-6%的环境中生长良好,而当盐度高于 10%或无盐时则完全不生长;VP 的生长温度为 15~44℃,最适生长温度为 35~37℃,在 72h时生长最旺盛[1],其在环境中的分布季节性明显,夏秋季是高发季节,同时对低温也有较好的耐受性,-70℃冻干状态下保存三月仍有 83%菌株为失活,但对高温抵抗力小,65℃环境下处理 5min 即会死亡,故通常采取-70℃冻干法进行保存[2];适宜生长的 p H 区间为 7.0-9.0,其中 pH7.7 最佳,在碱性环境下更易生存,对酸性环境是极度敏感[3],pH6 以下便不能生长。大多生存于内海岸的海水及海水淤积物和鱼、贝类等渔产品中 [4]。
目前,由副溶血性弧菌引起细菌食品中毒事故最多,胃肠炎属最典型疾病,同时也会通过海水感染伤口而引发败血症,这是一种危及生命的系统性疾病。而该弧菌也成了食源性中毒的主要细菌,其危险程度仅次之于沙门氏菌和霍乱弧菌。
..........................
1.2 水产养殖中对副溶血弧菌的防治
1.2.1 疫苗
免疫是一种相对安全的预防措施,目前已有 100 多种水产疫苗批准上市。VP外膜蛋白弧菌疫苗的主要免疫成分,其可通过识别异物激发机体的免疫反应。张伟妮[23] 等在实验中证实了包括 VP 等在内的 8 种弧菌共有的特异性抗原。目前,弧菌疫苗的使用主要通过三种方式,即浸泡、注射、口服。注射法效果好,但是对于水产品的免疫,其操作难度高,工作量大,副作用明显。浸泡法免疫效果不稳定不持久。因此口服疫苗的研究越加广泛。李梅芳[24] 等提取了副溶血弧菌外膜蛋白 K 微球为主要成分制作疫苗并对大黄鱼进行了口服免疫,结果证明大黄鱼可以产生中等程度的保护能力。然而,口服疫苗需要经过动物的消化系统,如何克服其不被消化酶消化分解是目前研制水产口服疫苗的关键所在。
1.2.2 抗生素
2.1 材料与方法
2.1.1 样品采集
从健康养殖的凡纳滨对虾养殖池塘中采集底泥 50g,并将其放入装入无菌袋中保存;采集养殖中期水样 500mL,装入无菌锥形瓶中保存。
第三章 发酵环境对枯草芽孢杆菌 D9 的拮抗作用研究 .................... 28..........................
1.2 水产养殖中对副溶血弧菌的防治
1.2.1 疫苗
免疫是一种相对安全的预防措施,目前已有 100 多种水产疫苗批准上市。VP外膜蛋白弧菌疫苗的主要免疫成分,其可通过识别异物激发机体的免疫反应。张伟妮[23] 等在实验中证实了包括 VP 等在内的 8 种弧菌共有的特异性抗原。目前,弧菌疫苗的使用主要通过三种方式,即浸泡、注射、口服。注射法效果好,但是对于水产品的免疫,其操作难度高,工作量大,副作用明显。浸泡法免疫效果不稳定不持久。因此口服疫苗的研究越加广泛。李梅芳[24] 等提取了副溶血弧菌外膜蛋白 K 微球为主要成分制作疫苗并对大黄鱼进行了口服免疫,结果证明大黄鱼可以产生中等程度的保护能力。然而,口服疫苗需要经过动物的消化系统,如何克服其不被消化酶消化分解是目前研制水产口服疫苗的关键所在。
1.2.2 抗生素
抗生素能杀灭和抑制特异性微生物的生长,所以在水产抑菌方面,抗生素也发挥了巨大的作用。不仅有效的实现了水产疾病的治疗,保证水产品的健康与安全,还能够加快水产品的生长,减少成本投入和养分需求,实现一定的经济效益。研究证明,四环素、庆大霉素、环丙沙星等均可有效抑制副溶血弧菌的生长,可作为防治副溶血弧菌病暴发时的药物进行治疗。
然而由于抗生素长期的不合理使用或过度使用,目前已有许多研究显示副溶血弧菌的耐药性越来越强,且出现了很多双重耐药的现象[25]。唐震[26]等在对 2015-2017年江苏省水产品 VP 的耐药性测试中显示,其耐药率高达 93.88%,且对 15 种抗生素均有不同程度的耐药。吴蓓蓓[27]等从宁波地区分离出 90 株副溶血弧菌分离株,结果显示所有分离株对氟喹诺酮类、氯霉素类、四环素类药物均敏感,药物数量 2~10种,耐药率达 90%以上。
然而由于抗生素长期的不合理使用或过度使用,目前已有许多研究显示副溶血弧菌的耐药性越来越强,且出现了很多双重耐药的现象[25]。唐震[26]等在对 2015-2017年江苏省水产品 VP 的耐药性测试中显示,其耐药率高达 93.88%,且对 15 种抗生素均有不同程度的耐药。吴蓓蓓[27]等从宁波地区分离出 90 株副溶血弧菌分离株,结果显示所有分离株对氟喹诺酮类、氯霉素类、四环素类药物均敏感,药物数量 2~10种,耐药率达 90%以上。
......................
第二章 副溶血性弧菌拮抗菌的筛选与鉴定
第二章 副溶血性弧菌拮抗菌的筛选与鉴定
2.1 材料与方法
2.1.1 样品采集
从健康养殖的凡纳滨对虾养殖池塘中采集底泥 50g,并将其放入装入无菌袋中保存;采集养殖中期水样 500mL,装入无菌锥形瓶中保存。
2.1.2 指示菌
试验用副溶血性弧菌(Vibriopara haemolyticus)是从患病对虾养殖肠道中分离,通过涂 TCBS 琼脂平板获得单菌落,经生理生化鉴定、科赫法感染鉴定,确定为致病性副溶血弧菌。
金黄色葡萄球菌(Staphylococcus aureus)、铜绿假单胞菌(Pseudomonas aeruginosa)、致病性大肠杆菌(Escherichia coli)、嗜水气单胞菌(Aeromonas hydrophila)、创伤弧菌(Vibrio vulnificus)、哈维氏弧菌(Vibrio harveyi)由本实验室保存于-80℃冰箱中。
试验用副溶血性弧菌(Vibriopara haemolyticus)是从患病对虾养殖肠道中分离,通过涂 TCBS 琼脂平板获得单菌落,经生理生化鉴定、科赫法感染鉴定,确定为致病性副溶血弧菌。
金黄色葡萄球菌(Staphylococcus aureus)、铜绿假单胞菌(Pseudomonas aeruginosa)、致病性大肠杆菌(Escherichia coli)、嗜水气单胞菌(Aeromonas hydrophila)、创伤弧菌(Vibrio vulnificus)、哈维氏弧菌(Vibrio harveyi)由本实验室保存于-80℃冰箱中。
2.1.3 培养基
刺激芽孢生长培养基:18g 营养肉汤,可溶性淀粉 3g,MgS04 0.1g,KH2P041.5g,Na2HP04 1.5g,水 1000mL,pH7.0~7.2。
芽孢菌分离培养基:蛋白胨 3g,葡萄糖 5g,酵母膏 5g,KH2P044g,MgS040.1g,琼脂 18g,水 1000mL,pH7.0~7.2 (加热煮好后加 3.08%MnS04)。
此外,实验中所用乳酸杆菌琼脂培养基、芽孢杆菌培养基、2216E 海洋培养基、营养肉汤琼脂、TCBS 琼脂、碱性蛋白胨水培养基(APW)均购于青岛高科园海博生物科技有限公司,并在使用前于 121℃高压灭菌锅中灭菌 21min。
刺激芽孢生长培养基:18g 营养肉汤,可溶性淀粉 3g,MgS04 0.1g,KH2P041.5g,Na2HP04 1.5g,水 1000mL,pH7.0~7.2。
芽孢菌分离培养基:蛋白胨 3g,葡萄糖 5g,酵母膏 5g,KH2P044g,MgS040.1g,琼脂 18g,水 1000mL,pH7.0~7.2 (加热煮好后加 3.08%MnS04)。
此外,实验中所用乳酸杆菌琼脂培养基、芽孢杆菌培养基、2216E 海洋培养基、营养肉汤琼脂、TCBS 琼脂、碱性蛋白胨水培养基(APW)均购于青岛高科园海博生物科技有限公司,并在使用前于 121℃高压灭菌锅中灭菌 21min。
............................
......................
2.2 结果分析
2.2.1 细菌分离统计
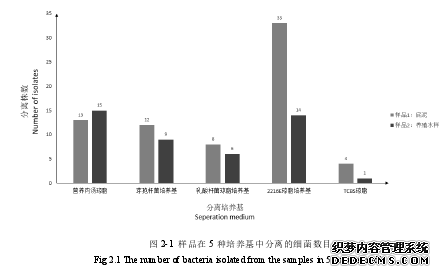
在 5 种培养基中工分离出 119 株细菌,其中在底泥中分离出 71 株,,养殖水样中分离到 48 株。根据分离的培养基的不同,将分离自营养肉汤琼脂培养基中的细菌编号 A 组,共 28 株;将分离自芽孢杆菌培养基中的细菌编号 B 组,共 21 株;将分离自乳酸杆菌琼脂培养基中的细菌编号 C 组,共 14 株;将分离自 2216E 琼脂培养基中的细菌编号 D 组,共 47 株;将分离自 TCBS 琼脂培养基中的细菌编号 E 组,共 9 株;
2.2.1 细菌分离统计
在 5 种培养基中工分离出 119 株细菌,其中在底泥中分离出 71 株,,养殖水样中分离到 48 株。根据分离的培养基的不同,将分离自营养肉汤琼脂培养基中的细菌编号 A 组,共 28 株;将分离自芽孢杆菌培养基中的细菌编号 B 组,共 21 株;将分离自乳酸杆菌琼脂培养基中的细菌编号 C 组,共 14 株;将分离自 2216E 琼脂培养基中的细菌编号 D 组,共 47 株;将分离自 TCBS 琼脂培养基中的细菌编号 E 组,共 9 株;

......................
3.1 材料与方法 .................... 28
3.1.1 菌种 .......................... 28
3.1.2 实验试剂 ........................... 28
第四章 拮抗菌 D9 对水体弧菌数量变化的影响 .......................... 40
4.1 材料与方法 ......................... 40
4.1.1 菌种制备 ........................ 40
4.1.2 实验试剂 ............................ 40
五、总结与展望 .............................. 46
5.1 总结 ................................... 46
5.1.1 副溶血性弧菌拮抗菌的筛选与鉴定 ....................... 46
5.1.2 发酵环境对枯草芽孢杆菌 D9 的拮抗作用研究 .............. 46
第四章 拮抗菌 D9 对水体弧菌数量变化的影响
4.1 材料与方法
4.1.1 菌种制备
供试枯草芽孢杆菌 D9 菌株由本实验室分离-80℃保存,将其取出接种于 100mL的营养培养基中,30℃,150rpm,震荡培养 24h 后,转接 2 代备用;副溶血弧菌菌株由本实验室保存的致病性菌种。将其接种于碱性蛋白胨培养基(APW)中 30℃,150rpm,培养 24h,转接 2 代备用。
4.1.1 菌种制备
供试枯草芽孢杆菌 D9 菌株由本实验室分离-80℃保存,将其取出接种于 100mL的营养培养基中,30℃,150rpm,震荡培养 24h 后,转接 2 代备用;副溶血弧菌菌株由本实验室保存的致病性菌种。将其接种于碱性蛋白胨培养基(APW)中 30℃,150rpm,培养 24h,转接 2 代备用。
4.1.2 实验试剂
营养肉汤琼脂培养基、碱性蛋白胨培养基(APW)、TCBS 琼脂培养基。稀释副溶血弧菌种子液浓度至 106cfu/mL 量级,再通过稀释菌株 D9 的种子液,使液体培养基中菌株 D9 的浓度与 VP 浓度比为 0.01:1、0.5:1、0.1:1、1:1、10:1、50:1、100:1,另外设置不加 D9 的弧菌生长液作为对照组,取 24 个 100 mL的锥形瓶,加入 98 mL 的营养肉汤培养基,加入相应浓度菌液,置于 34 ℃、150 r/min的摇床中培养。在试验开始 4 h,8 h,12 h,24 h 时在每组中取 1 mL 菌液,稀释到最适浓度涂 TCBS 平板。实验中设置三组平行组,记录弧菌数量计算平均值。每次取完 1 mL 菌液后补充 1 mL 液体培养基。
营养肉汤琼脂培养基、碱性蛋白胨培养基(APW)、TCBS 琼脂培养基。稀释副溶血弧菌种子液浓度至 106cfu/mL 量级,再通过稀释菌株 D9 的种子液,使液体培养基中菌株 D9 的浓度与 VP 浓度比为 0.01:1、0.5:1、0.1:1、1:1、10:1、50:1、100:1,另外设置不加 D9 的弧菌生长液作为对照组,取 24 个 100 mL的锥形瓶,加入 98 mL 的营养肉汤培养基,加入相应浓度菌液,置于 34 ℃、150 r/min的摇床中培养。在试验开始 4 h,8 h,12 h,24 h 时在每组中取 1 mL 菌液,稀释到最适浓度涂 TCBS 平板。实验中设置三组平行组,记录弧菌数量计算平均值。每次取完 1 mL 菌液后补充 1 mL 液体培养基。
...................
五、总结与展望
5.1 总结
5.1.1 副溶血性弧菌拮抗菌的筛选与鉴定
本章通过六步筛选步骤,最终筛选出效果最好的拮抗菌菌株 D9。文中,以水产养殖系统中的底泥和水样为样本,并在其中分离了 119 株菌株,通过点种法,发现仅 14 株有拮抗效果,其中有 4 株菌株的抑菌圈达 10mm 以上。再在营养平板上进行 5 次传代后,仍然保留拮抗效果的是 A5、B12、B18、D9、D14、D53。再对这六株菌株采用滤纸片法,利用发酵液和上清液进行二次筛选,最后仅 A5、D9 的上清液有抑菌圈,且上清液的抑菌圈略小于发酵液。然后对拮抗菌 A5 和 D9 进行抗菌谱的测定,结果显示,D9 的抗菌谱更广,故选择菌株 D9 进行菌种鉴定。
5.1 总结
5.1.1 副溶血性弧菌拮抗菌的筛选与鉴定
本章通过六步筛选步骤,最终筛选出效果最好的拮抗菌菌株 D9。文中,以水产养殖系统中的底泥和水样为样本,并在其中分离了 119 株菌株,通过点种法,发现仅 14 株有拮抗效果,其中有 4 株菌株的抑菌圈达 10mm 以上。再在营养平板上进行 5 次传代后,仍然保留拮抗效果的是 A5、B12、B18、D9、D14、D53。再对这六株菌株采用滤纸片法,利用发酵液和上清液进行二次筛选,最后仅 A5、D9 的上清液有抑菌圈,且上清液的抑菌圈略小于发酵液。然后对拮抗菌 A5 和 D9 进行抗菌谱的测定,结果显示,D9 的抗菌谱更广,故选择菌株 D9 进行菌种鉴定。
根据形态学和生理生态学的初步鉴定,结果显示,该菌菌落颜色呈淡黄色,不透明,菌落大小为 1.02±0.06mm,中间隆起,边缘和表面均光滑。革兰氏染色镜检显示,菌株 D9 呈革兰氏阳性菌,有芽孢,杆状。用悬滴法观察 D9 的菌液,发现其运动速度较快,初步鉴定为芽孢杆菌属。然后通过 16sDNA 获得 1123 个碱基,经过 NCBI 数据库同源性对比,D9 属于枯草芽孢杆菌,同源性达 100%。#p#分页标题#e#
最后对菌株 D9 进行了环境稳定性测试,菌株 D9 的上清液经过 60~120℃的加热处理、pH1~11 的处理、紫外线照射处理后,均未使其丧失抑菌活性,说明菌株D9 的耐高温,耐酸碱,耐紫外线。
参考文献(略)
参考文献(略)

