制药工程论文哪里有?本文从传统确认工作的进度安排出发,结合关键路径法、IDEF0模型法和 ASME 分析法对确认流程进行分析,构建了简化确认体系。本文以制药工程项目验证体系的进度延迟为突破口,结合当前国内外工程项目交付的问题进行研究,得出影响确认工作量的三大要素,构建了缺陷移除效率模型,并将该模型用于实践案例分析中进行验证。希望通过本文,能够从时间上和质量上优化当前制药工程项目的验证体系。
第 1 章 绪论
1.3.1 国外制药工程项目确认和项目进度研究现状
GMP 的概念最早起源于美国,主要是因为反应停事件,该药物造成了 1300 多例关于多发性神经炎的副作用案例。美国因为没有批准反应停药物的引入,避免了该药物的副作用对美国的影响。为此,美国吸取相应的经验,于 1963 年颁布了第一部 GMP 法规来保证药品的质量。1969 年第 22 届世界卫生大会 WHO 建议各成员国的药品生产采用 GMP 制度。1970 年至 1976 年美国国内出现了一些列因为输液剂引发的败血症案例,美国食品药品监督管理局介入调查后发现,与败血症相关的输液产品并不是没有进行无菌检查,或者将不合格产品投入生产,而是因为无菌检查自身的局限性,设备和系统的设计建造的缺陷,以及生产过程出现偏差所致。对此在制药工程领域首次提出“药品质量是生产出来的而非检验出来的”。1976 年美国出版的《大容量注射剂 GMP 规程》[5]中引入了验证的概念,以确保生产设备和系统,生产过程对药品质量的保证。验证的概念的引入,使得药品质量在生产过程中得到保证。
国外对工程项目的确认和验证流程的研究大多集中在 90 年代和 20 年代初,其主要研究方向是对确认和验证的重要性进行阐述,以及将确认和验证的实际应用。如 90 年代 Buick A R、Doig M V 等对实验室分析方法验证的目的和意义的阐述,以及实验室分析方法验证的具体操作流程[6]。Werner R G、Langlouis-Gau H 在研究生物制剂的生产过程中,指明工艺验证可以保证生物制剂生产过程的稳定性[7]。如 Jennings T A、Scheer A、Emodi A 等应用安装检查确定了烘干机的设计和构造与提议的硬件和设计规范相一致,阐明了安装确认的重要性[8]。L. Huber 和 Lou Welebob 强调了运行测试中测试标准的确定准则的重要意义 [9]。 Fields 和 Timothy J 针对于某一装箱机的确认过程的实例进行分析,指出确认过程中需要注意的事项[10]。

第 3 章 制药工程项目确认进度分析
3.1 关键路径法解析制药工程项目的确认过程
3.1.1 制药工程项目确认的 WBS 分解
制药工程项目中直接影响药品质量的公用工程系统和生产设备需要经过确认,确认完成后才能进行系统交付。确认过程贯穿了系统从设计至交付的全过程。对药品质量有直接影响的系统一般分为三部分:一是为公用工程系统包括空调系统,纯化水,压缩空气以及洁净蒸汽系统等。二是参与生产的生产设备。三是参与生产的自动化系统。公用工程系统、生产设备和自动化系统其确认流程是一致的,确认中涉及的确认测试文档也是相同的。不同的是供应商的文档,以及不同项目现场安装、调试测试的时间不一致。
基于确认流程和确认文档的一致性,所以对确认流程中的关键路径进行优化,以及对文档体系进行优化能够从根本上提高制药工程项目的效率。
DQ、IQ、OQ 和 PQ 的测试文档都是基于用户需求和功能风险评估指定的。RA 实际上是对用户需求、功能等进行风险评估,识别出潜在的风险,制定出后续在安装确认、运行确认、性能确认中需要检查的项目。在每步确认完成后,还需要对这些情况的完成与否进行追踪,以防止有漏项测试。也有的项目会在最后阶段再进行回顾,对所有测试项目进行总结,以确保所有 RA 识别出的项目都经过测试,且测试结果均符合要求。功能风险评估在制定的过程中,是针对用户需求和功能风险评估进行的,将 GMPRA 和验证文档进行合并,减少了每个阶段的GMPRA 回顾工作。将文件的准备工作转移至项目的设计阶段,而该阶段的工作主要是项目的各专业的设计工程师。
第 5 章 N 扩展项目结合缺陷移除模型分析
5.1 N 扩展项目概况
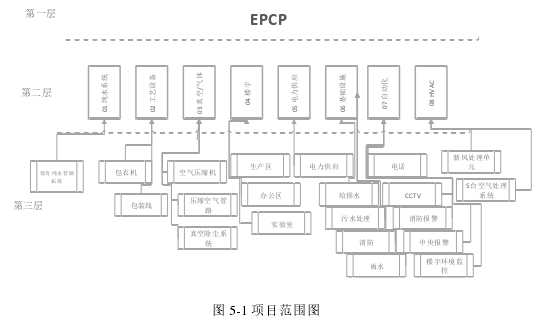
N 制药工厂拓建项目工程位于北京市东北部,其目的是扩展现有公司当前的生产能力,为后续扩大化生产进行准备。整个项目总投资额为 1.9 亿人民币,整个项目涉及建筑面积为 2600 平方米,为上下两层结构,一层为生产区域,二层为办公区和实验室。项目内拟增加五台空调系统,一台新风处理单元,当前纯水管路的扩充,增加一台空压机系统并合并至现有空压机系统中,一台高速包装线,一台制药用包衣机,以及给排水,电力供应配置等。其他区域为预留区域,为后续产能增加做好准备。
5.1.1 N 扩展项目范围详述
为了便于项目的管理,按照工作分解结构(WBS)对该整个项目进行分解。此次分解为三层结构,第一层为项目整体,第二层为主要的工作组,主要有:纯水、楼宇、气体、基础设施、自动化、配电系统、空调。第三层为工作组进行细分至相应的工作单元或者设备层。具体如下为图 5-1。
5.2 N 项目传统确认过程
5.2.1 N 项目自身确认和验证体系
项目中的所有系统经过确认需求评估,确认出直接影响产品生产质量的系统有纯水系统、空气压缩机及管路、供应生产的 3 台空调系统、洁净区域、房间监控系统、包装线和包衣机,地秤,压片机,共计 17 项系统需要进行确认,此处不包含 QC 检测设备。结合项目所有系统共计 76 个系统。通过 QNA,将确认验证工作主要关注在对药品生产质量有直接影响的系统。其他非直接影响产品质量的系统会按照 GEP(良好的工程规范)进行调试检查。
概念设计阶段:该阶段项目的主确认方案,项目风险评估,项目的 QNA 得到批准。另外整个项目的平面图,项目涉及的系统得到初步的确认评估。
在基础设计阶段,每个系统的用户需求(URS)以及系统的 GMP 和功能风险评估得到(GMPRA)审批,此时对应的系统 P&ID(管路和仪表图纸)和功能说明(FS)进行初步审阅批。
详细设计阶段:单个系统的确认方案,系统的电路图,配置文档,系统内仪表和部件的风险评估等设计文档进行批准。
安装调试:安装施工是按照设计的图纸进行安装,调试。并且按照 GEP 的规则进行安装检查和调试检查,该检查是针对项目中的所有系统
安装确认:按照涉及的图纸,对安装过程进行检查,以确保现场安装符合要求。
运行确认:按照功能说明,对现场进行测试,确保其功能符合要求。
第 6 章 结论与展望
6.1 研究结论
制药工程项目的确认和验证体系的研究更多的是对流程的研究,来保证验证体系的合规性。本文从传统确认工作的进度安排出发,结合关键路径法、IDEF0模型法和 ASME 分析法对确认流程进行分析,构建了简化确认体系。本文以制药工程项目验证体系的进度延迟为突破口,结合当前国内外工程项目交付的问题进行研究,得出影响确认工作量的三大要素,构建了缺陷移除效率模型,并将该模型用于实践案例分析中进行验证。希望通过本文,能够从时间上和质量上优化当前制药工程项目的验证体系。
本文的主要研究工作如下:
(1)对传统的确认和验证体系和流程进行研究,应用关键路径法对流程进行优化。通过对制药工程项目的验证工作进行分析,构建了验证项目的 IDEF0模型。并按照 ASME 对现有文件批准流程进行分解,识别出批准流程的增值部分和非增值部分。最终构建了简化的确认体系。
(2)目前制药工程项目的验证体系质量评估方法更多的是使用蒙特卡洛、AHP 等方法,缺陷移除效率模型一直应用软件开发领用。应用缺陷移除率模型用于制药工程项目的验证体系还是空白,本文应用了缺陷移除模型于制药工程项目的验证体系质量和进度评估,并对该进度评估的步骤进行了详细分解。此外本文通过对人员、流程和测试时间占项目生命周期的比值进行分析,构建了缺陷移除率的估算模型,保证计算的准确性。
(3)通过对 N 制药工厂的扩展项目进行分析,研究该项目的缺陷清单,对缺陷清单进行分类,例证造成制药工程项目缺陷的主要问题,并对此进一步分析,采用优化的验证流程的方法解决当前项目的主要问题。运用缺陷移除模型对该项目进行分析,对该项目的实际缺陷移除率进行计算。应用缺陷移除率的估算方法,对该项目的缺陷移除率进行估算。将估算的缺陷移除率和实际计算的缺陷移除率进行配比 T 检验分析,结果显示两组数据之间不存在显著差异,代表该估算的缺陷移除率可以用于后续制药工程项目的进度评估中。
参考文献(略)

