前 言
骨关节炎是严重影响人类健康的一种常见的关节疾患,OA的主要表现为缓慢发展的关节疼痛、僵硬和肿大,常常伴有关节功能障碍,甚至可能发生残疾。特别是随着人口老龄化趋势的延续,各种因素造成了关节软骨损伤和退行性病变所致的 OA 已经成为中老年患者中的常见疾病。根据流行病学调查的结果,在 65 岁以上的老年人中约有 2/3 罹患 OA。在美国,OA 的发病率占总人口的20%作用,在我国虽然尚无明确的全国范围的流行病学调查数据,但从北京地区的调查结构分析,超过 50%的老龄人口发生了 OA 的影像学改变。OA 的主要治疗方法是减少关节的负重和过度的大幅度活动,从而延缓疾病进程。消炎镇痛药物可减轻或控制症状,但应在评估患者风险因素后慎重使用,同时这些药物不宜长期服用,而软骨保护剂(例如:硫酸氨基葡萄糖)具有缓解症状和改善关节功能的作用,同时长期使用可延迟疾病的结构性进展。而对于晚期的 OA 患者,实施人工关节置换术是目前公认的消除疼痛、矫正畸形和改善功能的有效方法,可大大提高患者的生活质量。但人工关节置换术存在费用昂贵、患者不能耐受以及需要再次置换等多种问题。更为重要的是,OA 的发病机制尚未完全阐明。因此,迫切需要加强对影响 OA发病和临床转归的相关机制研究,从而衍生和制定出更为有效的治疗方法和措施。研究表明,多种因素(包括遗传因素、免疫因素、生活方式等)均影响着 OA的发病,特别是年龄、关节外伤以及生物力学的改变是其中的关键性影响因素。由于 OA 的发病原因复杂,因此,目前认为 OA 并非是一种独立的疾病,而是多种功能失调所致的全身一个或多个关节的功能衰竭。同时,机体的免疫应答与局部关节软骨及滑膜组织的破坏产生相互作用,最终导致慢性关节炎症的发生。因此,免疫因素在 OA 发病和临床转归中的作用已经成为研究的热点之一。在 OA 的发病环节中,造成软骨基质降解的最直接的因素就是炎症性细胞因子。多种生长因子和细胞因子(包括:白细胞介素、血管内皮生长因子、成纤维生长因子、转移生长因子、胰岛素样因子、胰岛素样生长因子结合蛋白)等均参与了 OA 的致病过程。这些因子形成网络级联系统,各种分子之间相互影响、相互作用,通过多种激活途径,产生相应的生物学效应,最终导致软骨基质降解和软骨细胞凋亡。然而,关节软骨的再生修复能力非常有限,一旦破坏几乎不能逆转。因此,需要在 OA 的疾病早期对病变进行有效的干预才能延缓甚至逆转 OA 疾病的发生,这其中的关键问题在于阐释这些细胞因子/趋化因子的分子通路及其对软骨细胞的作用,揭示 OA 发病机制的网络效应。
但是,现有的研究结果多集中于单个或几种细胞因子及趋化因子,对 OA 患者细胞因子/趋化因子的表达谱变化尚未见相关报道,同时,多年以来,研究者们试图寻找调节 OA 特异性的致病基因或因素,但发生表达变化的细胞因子和趋化因子对软骨细胞产生何种影响亦不清楚。因此,本研究拟收集 OA 患者的外周血和滑液,利用Milliplex 多因子检测技术对 OA患者和健康志愿者外周血和滑液中共 47种细胞因子和趋化因子的水平进行检测,比较两组间的表达差异,并分析这些因子的表达变化与相关临床过程的相关性。进一步分离原代软骨细胞,利用发生表达变化的细胞因子/趋化因子对原代软骨细胞进行刺激培养,观察刺激后原代软骨细胞在增殖和凋亡、生命周期、分泌细胞因子水平等方面的变化,并进一步分析这些细胞因子/趋化因子对软骨细胞中信号转导通路的影响。为 OA 发病机制的研究提供理论和实验依据,为 OA 的治疗提供新的靶点。
.........
文献回顾
骨关节炎(osteoarthritis, OA)曾被认为是一种非炎症性关节炎,也曾被称为退行性关节炎(degenerative arthritis)或退行性关节病(degenerative joint disease)。早期的研究发现,OA 患者的关节滑液中未发现白细胞,而在类风湿性关节炎(rheumatoid arthritis, RA)、活动性关节炎以及化脓性关节炎患者的关节滑液中均发现了显著升高的白细胞。而早在 1976 年,有科学家就发现了一种被称为“创伤后滑膜炎”的疾病[1],其病理改变与目前被命名为原发性骨关节炎的疾病极为相似。目前的研究认为,OA 患者多数伴随滑膜炎,因此,炎症应答已被认为是 OA 发病机制中极为重要的因素之一[2]。但这并不意味着所有 OA 的发病机制均与滑膜相关。而滑膜炎往往伴随于关节软骨损伤所造成的固有免疫激活,这也为 OA 的发病和预后提供了重要的连锁关系。OA 的发生与多种危险因素相关,而其中最为重要的因素包括年龄、关节外伤、生物力学的改变以及妊娠[3]。由于 OA 的发病与多种复杂的因素相关, 因此,OA并非一种独立的疾病,而是多种功能失调所致的全身一个或多个关节功能衰竭。既往的研究也发现,OA 的病理改变的特征可导致相似的临床结局,即永久的关节破坏和最终的功能衰竭[4]。而这一临床结局的关键影响因素也包括了生物化学和生物力学的进程,而机体的免疫应答与局部关节软骨及滑膜组织的破坏也可相互作用,最终导致慢性关节炎症的发生。OA 的发病的关键因素在于是由于单次关节外伤或关节生物力学改变所致的反复微小创伤所致外界受力改变而导致关节组织的损伤[5],软骨细胞对外界的损伤刺激产生应答,主要表现为停止分泌合成代谢的因子以及释放更多的分解代谢酶(如:基质金属蛋白酶,matrix metalloproteinases, [MMP]),这一过程则可导致软骨进一步损伤[6],并释放细胞基质组成成分,诱导炎症应答的发生[7]。目前 OA 的发生与固有免疫和适应性免疫均相关,主要包括以下依据:①在针对OA 患者进行的大规模流行病学调查中发现,炎症性滑膜炎/滑膜损伤增加软骨损伤和疼痛的发生[8, 9]。②OA 患者的软骨组织中检测到了免疫细胞(包括 T 细胞、B 细胞和巨噬细胞)的浸润[10-12]。③OA 患者的软骨、滑膜和血浆中可检测到免疫球蛋白和针对软骨成分的免疫复合物[7]。④补体系统的活化在 OA 滑膜炎中发挥关键性作用[13]。因此,机体免疫系统所介导的炎症应答在 OA 的发病中发挥了重要的作用。
........
1. OA 是一种炎症性疾病
对于OA是一种炎症性疾病的认识还是归功于对RA和其它经典的炎症性关节炎的研究中炎症因素所发挥的重要作用。在早期对 RA 的研究中,以 OA 患者的组织和关节滑液作为对照,发现 RA 患者中炎症蛋白的水平显著升高[14, 15]。尽管 RA 患者存在更为显著的组织学和生化学的异常,但早在 1959 年的研究中就发现了 OA 患者的血液和关节滑液中亦存在高水平的炎症蛋白表达[16]。因此,作者认为:“这可能提示 OA 和 RA 患者中存在着相似的滑膜组织通透性的改变,但这种改变在 RA 患者中更为明显”[16]。以 OA 患者的关节滑液和组织作为 RA 的对照并认为 OA 是非炎症性关节炎的观点已经存在很大的争议并逐步扩大,也促使研究者不断进行相关的研究,发现与正常的关节滑液和组织比较,OA 患者的关节滑液和组织中也富含炎症蛋白,补体组成成分[17]和细胞因子[18]。更有研究认为,在某些病例中,OA 和 RA患者关节炎的水平几乎没有差异[19]。这些研究结果使得 OA 从“非炎症性、损耗性”关节炎的观念中走出,逐渐改变着研究者和临床医生对 OA 发病和治疗的观念。Sohn 等应用现代的研究工具和技术对 OA 和 RA 患者关节滑液以及 OA、RA 和健康志愿者血清中炎症性因子的表达水平和特征进行了检测[18],其研究结果与 1959年 Nettelbladt 等[16]的研究结果相似。研究发现,多种炎症性细胞因子的水平在健康志愿者血清、OA 患者血清、OA 患者关节滑液、RA 患者血清、RA 患者关节滑液中的表达成逐渐升高的趋势[18]。尽管 RA 与高炎症应答水平显著相关,但并不能认为OA 是一种“非炎症性”的疾病。另有研究结果对系统性炎症与 OA 相关的发现进行了进一步支持。流行病学分析发现,血清 C 反应蛋白(C-reactive protein, CRP)的水平与膝关节 OA 的发生和进展显著相关[20]。也有研究发现,在行关节置换术的患者中,血清 CRP 的水平与关节炎的组织病理学改变以及关节滑液中白细胞介素(interleukin, IL)-6 的水平呈显著正相关[21]。这些研究结果均提示 OA 患者中存在的系统性炎症应答可部分反映局部关节的炎症应答。
1.1 早期 OA:关节炎症发生在结构改变之前
临床医生常认为 OA 主要表现为软骨丢失和关节间隙变窄。实际上,美国风湿病学会指南则指出 OA 的诊断标准必须包括骨质增生和骨赘形成的影像学表现[22]。目前的研究已清楚的表明,OA 患者的炎症发生在重要影像学改变之前。敏感影像学检查结合关节镜下的直接观察已发现,即使在 OA 的疾病最早期,即关节软骨发生可见的退行性改变之前,OA 已经是一种炎症性疾病。对有症状但未发生影像学改变的 OA 患者进行膝关节镜检查时,发现关节滑膜炎的表现与后续内侧关节软骨的丢失密切相关[8]。增强或平扫的磁共振(magnetic resonance image, MRI)检查均发现滑膜炎与 OA 的疾病进展密切相关[23-25]。另有研究也支持 OA 疾病的最早期即有炎症发生的观点。在对 70 例未发生影像学变化的 OA 患者进行滑膜组织检查时发现,31%的患者发生了严重的滑膜炎症,这提示在许多仅发生微小影像学改变或未发生影像学改变的 OA 患者中已经发生了滑膜炎症[26]。Benito 等在对早期和晚期 OA 患者进行对比时发现,早期 OA 患者单个核细胞的浸润显著增加,炎症介质的表达明显升高[27]。最后,在对未发生影像学改变的 OA 患者进行关节镜下半月板切除术以修复创伤性半月板损伤的研究中发现,43%的患者存在滑膜炎症且与术前疼痛的严重程度和功能评分密切相关[28]。上述研究均发现,OA 疾病早期即出现了严重的滑膜炎症,提示在 OA 疾病早期可能存在针对炎症应答过程从而改变疾病进程的机会以预防和治疗 OA。#p#分页标题#e#
..........
2 方法.........49
2.1 软骨细胞的分离和培养 .............49
2.2 软骨细胞的刺激培养 ..............49
2.3 细胞增殖检测(CCK-8 法) ...........50
2.4 细胞周期和凋亡检测(PI 染色法和流式细胞术) .............50
2.5 细胞分泌上清中相关细胞因子的检测(ELISA 法) ............51
2.6 CXCL8/IL-8 和 CXCL11 下游信号转导通路分析 ..........52
2.7 统计学分析 .......54
3 结果.........54
3.1 软骨细胞原代培养特征 .............54
3.2 CXCL8/IL8 和 CXCL11 对软骨细胞增殖和凋亡的影响 ...........55
3.3 CXCL8/IL8 和 CXCL11 对软骨细胞分泌细胞因子的影响 ..........57
3.4 CXCL8/IL8 和 CXCL11 对软骨细胞中 JAK-STAT、MAPK 和 NK-κB 信号转导通路的影响 ..............57
4 讨论.........58
4 讨论
在第一部分研究中,我们发现 CXCL8/IL-8 和 CXCL11 与 OA 患者的发病以及疾病严重程度相关,因此,在本部分研究中,我们主要针对 CXCL8/IL-8 以及 CXCL11两种趋化因子对从 OA 患者分离关节软骨中分离出的原代培养软骨细胞的增殖、凋亡、分泌细胞因子等的影响进行了研究。我们发现,CXCL8/IL-8 和 CXCL11 均可抑制软骨细胞的增殖,同时促进软骨细胞的凋亡,并促进软骨细胞分泌多种促进炎症应答的细胞因子,从而进一步诱导 OA 的发生,提示这两种趋化因子在 OA 的发病中发挥重要作用。但这两种因子在 OA 发病中的作用及相关机制尚不清楚,我们进一步对相关细胞信号转导通路中的磷酸化蛋白水平进行了检测。经典的 IL-8 信号转导通路主要通过 IL-8 与受体 CXCR1/2 结合后活化 Gaβγ,进而活化初级效应中的 PI3K 或 PLC 而实现的,活化的 PI3K 或 PLC 可进一步活化 Akt、蛋白激酶 C、引起钙动员或 MAPK 信号级联反应。这些信号通路可促进蛋白质的翻译和一系列转录因子的活性变化。IL-8 调控转录因子的活性可以通过影响 STAT3 核移位(即影响 JAK-STAT 信号通路)[211]、促进 p38MAPK 磷酸化(即影响 p38MAPK信号通路)[212]以及促使 NF-κB 核移位(即影响 NF-κB 信号通路)[213]而发挥作用。但有关 CXCL11 相关信号通路的研究则较少。JAK-STAT 信号转导通路主要包括酪氨酸蛋白激酶(JAK)、信号转导因子和转录活化因子(STAT)、核定位信号肽段以及细胞核内靶向 DNA 分子等,其信号传递过程相对简单,细胞因子与相应受体结合后引起受体分子二聚体化,这使得与受体偶联的 JAK 激酶相互接近并通过交互的酪氨酸磷酸化作用而活化。活化的 JAK 催化受体酪氨酸残基磷酸化,进一步与周围氨基酸序列形成停泊位点,同时含有 SH2 结构域的 STS 蛋白被募集至停泊位点,JAK 催化结合在受体上的 STAT 蛋白磷酸化,活化的 STAT 蛋白以二聚体形式进入细胞核与靶基因结合,调控基因转录[214]。STAT 蛋白在哺乳动物中有 7 类,而研究发现 IL-8相关信号通路参与的主要为 STAT3,因此,我们的研究也检测了磷酸化的 STAT3 水平。而 MAPK 激酶是非常保守的丝氨酸/苏氨酸蛋白激酶,主要有 4 个家族成员,包括 ERK1/2、JNK/SAPK、p38MAPK 和 ERK5/BMK1。其中,p38MAPK 是 MAPK 家族控制炎症反应最重要的成员,可因生理性应激、脂多糖、渗透性应激和紫外线照射而激活,多种炎症刺激均能而过诱导内源性免疫细胞中 p38MAPK 的激活,p38MAPK 磷酸化后发生核移位,对多种蛋白激酶和转录因子具有磷酸化和激活的作用[215, 216]。NF-κB 信号转导通路包括受体和受体近端信号衔接蛋白,IκB 激酶复合物、IκB 蛋白和 NF-κB 二聚体。当细胞受到各种胞内外刺激后,IκB 激酶被激活和 IκB蛋白磷酸化、泛素化,致使 IκB 蛋白被降解,NF-κB 二聚体释放,NF-κB 二聚体通过各种翻译后的修饰作用被进一步激活,并转移至细胞核中,与目的基因结合,促进目的基因转录[217]。Western Blot 结果发现,CXCL8/IL-8 和 CXCL11 刺激可以提高磷酸化 STAT3 和磷酸化 NF-κB p50 蛋白的水平,但磷酸化 p38MAPK 蛋白表达水平与对照组相比则无明显变化,这些结果说明 CXCL8/IL-8 和 CXCL11 均主要活化JAK-STAT 和 NF-κB 信号转导通路,但对 p38MAPK 信号转导通路的影响较小。两种趋化因子可能主要通路调控 JAK-STAT 和 NF-κB 信号转导通路而发挥促进 OA 发病的作用。

.........
小 结
1. OA 患者外周血中 CD4+T 细胞、CD8+T 细胞和 B 细胞的水平与健康志愿者比较无明显差异,但 NK 细胞水平,特别是分泌细胞因子的 CD56brightNK 细胞水平较健康志愿者中显著升高。
2. 对 OA 患者外周血中 47 种细胞因子/趋化因子的表达进行了分析,发现 7 种细胞因子/趋化因子在 OA 患者与健康志愿者之间的表达存在差异。其中,IL-1β、IL-8、IL-17A、TNF-α、CXCL9、CXCL11 的表达水平在 OA 患者中显著高于健康志愿者,反之,IL-10 的表达水平在 OA 患者中显著低于健康志愿者。有效的抗炎治疗可显著降低 OA 患者外周血中 IL-8、IL-17A、CXCL9 和 CXCL11 的表达水平.
3. OA 患者关节积液中存在 CXCL8/IL-8、IL-17A、CXCL9 和 CXCL11 的表达,其中 IL-8 和 CXCL11 的水平与 OA 疾病进程相关。
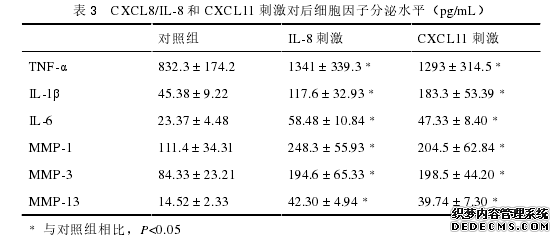
4. 建立了 OA 患者膝关节软骨细胞分离和原代培养的系统,并利用软骨细胞培养系统研究了CXCL8/IL-8和CXCL11对软骨细胞的影响及其机制。发现CXCL8/IL-8和 CXCL11 均可促进软骨细胞的凋亡、抑制软骨细胞的增殖,还可以促进软骨细胞分泌 TNF-α、IL-1β、IL-6、MMP-1、MMP-3 和 MMP-13 等多种促进炎症应答的细胞因子。进一步的分析发现,CXCL8/IL-8和CXCL11可以提高软骨细胞中磷酸化STAT3和磷酸化NF-κB的水平,但对磷酸化 p38MAPK 的水平无明显影响,提示 CXCL8/IL-8和 CXCL11 可能影响 JAK-STAT 和 NF-κB 信号转导通路,从而影响相关细胞因子的分泌和细胞增殖、凋亡过程,进而促进 OA 的疾病进程。以上结果均提示,CXCL8/IL-8和 CXCL11 这两种趋化因子在 OA 发病过程中发挥促进疾病进展的作用。
..........
参考文献(略)

