第一章 绪论
1.1引言
大豆(Glycine max L.)是一种非常有价值的农作物,为人类提供高品质的油脂与蛋白质。目前大豆全世界产量排名(2013)为:美国,7 107t;巴西,5.8 107t; 阿根廷,5.8 107t;中国,1.7 107t;印度,1.0 107t。大豆在中国等亚洲地区有超过 3000 年的种植历史,是重要的蛋白质来源,传统上以豆浆、豆腐、酱、味增、腐竹等形式被利用[1]。大豆蛋白的主要优点包括:含有所有的必需氨基酸,能提供良好的氨基酸平衡;含有生理功能成分,能降低胆固醇,减少高血脂和心血管疾病的风险,并且对肥胖症、糖尿病、骨骼与肾脏疾病具有积极作用[2-4];具有极好的功能性质,如凝胶性、乳化性、持水持油性等[5-9]。加热是大豆加工中一个非常重要的操作单元,它具有以下的一些作用:1)能钝化抗营养因子,如蛋白酶抑制剂,凝集素等;2)使大豆蛋白质变性,提高蛋白质消化率;3)减少豆腥味;4)消毒杀菌[1]。巯基(sulfhydryl, SH)与二硫键(disulfide bond, SS)是大豆蛋白重要的功能基团[10-11]。它们容易受到热处理的影响而发生巯基氧化反应和巯基/二硫键交换反应,促使蛋白质变性与聚集,从而改变蛋白质的营养和功能性质。例如,形成分子间的二硫键交联增强了大豆分离蛋白凝胶的硬度[12];胰蛋白酶抑制剂(Kunitztrypsin inhibitor, KTI)通过与其它蛋白质形成二硫键连接而失活[13]。但是目前关于大豆蛋白亚基水平上的巯基氧化反应和巯基/二硫键交换反应的过程尚不明确。因此,本研究以大豆蛋白亚基的巯基变化为研究重点,探讨巯基氧化反应和巯基/二硫键交换反应对于二硫键连接产物形成的机理,并考察分子间二硫键对于热聚集的作用。
………
1.2巯基和二硫键对实现蛋白质营养功能的作用
巯基(SH)的去质子形式——硫醇阴离子(S-)是活性最强的生物亲核体之一[14, 15]。巯基通过清除自由基、螯合过渡态金属离子等方式来实现其抗氧化性[16]。例如乳球蛋白的巯基通过清除自由基和螯合过渡态金属离子抑制乳状液中的脂质氧化,但是过度的热处理会降低巯基的抗氧化性[17-19]。巯基还有助于避免蛋白质氧化损伤[20]。豆科植物蛋白酶抑制剂和凝集素的巯基或二硫键发生巯基氧化反应或巯基/二硫键交换反应后,其结构遭破坏并失去活性,使豆制品的营养价值得到提高。在豆浆生产过程中,通过加热,KTI 中的二硫键与豆浆中的其它蛋白(如 11S 球蛋白)发生巯基/二硫键交换反应或巯基氧化反应,导致 KTI 空间结构发生变化——生物活性降低。BBI 由于是一种亲水性极强的蛋白质分子,其在加热过程中发生巯基/二硫键交换反应比 KTI 慢。由此可见,巯基能够促进大豆胰蛋白酶抑制剂的热失活,提高大豆蛋白的消化性[13, 22]。通过 NADP-thioredoxin system(NTS)还原大豆蛋白中的胰蛋白酶抑制剂(Kunitz trypsininhibitor, KTI),胰凝乳蛋白酶抑制剂(Bowman-Birk inhibitor, BBI)和 11S 球蛋白的二硫键,提高了大豆蛋白的消化率[11, 21]。另外,半胱氨酸等含巯基物质也可以通过还原二硫键来使胰蛋白酶抑制剂失活[11]。
…………
第二章 大豆蛋白巯基检测方法的研究
2.1引言
巯基(SH)和二硫键(SS)是两个重要的功能基团,影响大豆蛋白的营养和功能性质,例如聚集行为[1-2]、凝胶强度[3-4]、乳化和起泡性[5]、体外消化率[6]、过敏性[7]等。因此,检测 SH 和 SS 的含量是非常重要的,是进一步研究其性质与反应的基础。通常SS 含量是通过将总的半胱氨酸含量(包括 SH 和 SS)减去 SH 含量获得的,因此准确测定 SH 含量就显得非常重要。本章研究非还原条件下测定 SH 含量的方法。通常使用DTNB检测大豆蛋白的SH。DTNB与S-反应生成黄色的NTB,可在412 nm处检测(图 2-1)[8]。早期的研究所报道的大豆蛋白 SH 含量处于一个宽的范围(0.2-14.8μmol SH/g)[1, 2, 9-13]。这种差异可能是因为他们在各自的研究中使用了不同种类的大豆以及不同的蛋白质提取方法。然而,SH 测定方法的差异可能也是一个影响因素。在本章中,考察了 pH、DTNB 与变性剂(SDS/GuHCl)的添加顺序,变性剂浓度,及金属螯合剂乙二胺四乙酸二钠(EDTA)对测定 SH 含量的影响。这是因为在前述的研究中,使用了不同的变性剂(1% SDS,9 M 尿素,8 M 尿素,8 M 尿素和 0.5% SDS 的混合物,6 M尿素和0.5% SDS的混合物),不同的DTNB与变性剂的加入顺序[13],及不同的EDTA浓度。尿素被证实含有不同程度的氰酸盐(cyanate),能与 SH 反应生成硫代氨基甲酸酯(thiocarbamates),从而降低 SH 的检测值[15]。此外,由于 S-是最强的生物亲核体之一,使得半胱氨酸侧链 SH 是蛋白质中最具活力的功能基团之一。因此如果变性剂在DTNB 之前加入蛋白质溶液中,虽然能够使蛋白质去折叠以暴露内部 SH,但可能也会导致不期望的 SH 氧化。EDTA 能够螯合金属离子,降低 SH 氧化的程度。有报道认为低的 EDTA 浓度(0.2 mM)对于 SH 检测可能是合适的[16]。前述研究在检测 SH 时只使用单一的碱性 pH 8.0。Thurlkill[17]报道的半胱氨酸的侧链的 pKa 值是 8.55 ± 0.03,高的pH 值会加速 DTNB 的水解,同时增加 SH 氧化的可能[18]。
………
2.2材料与设备
2.2.1材料
大豆为市售东北大豆。5,5'-二硫代二硝基苯甲酸(DNTB)、4,4′-二硫二吡啶(DPS)、N-1-芘)马来酰亚胺(NPM)、十二烷基硫酸钠(SDS)、单溴二胺(mBBr)、N-乙基马来酰亚胺(NEM)、半胱氨酸均购自 Sigma-Aldrich 公司。三羟甲基氨基甲烷(Tris)、盐酸、氢氧化钠、盐酸胍(GuHCl)、乙二胺四乙酸二钠(EDTA)、二氯甲烷、正己烷、己烷、乙醇、甲醇、冰乙酸、磷酸氢二钠和磷酸二氢钠等均购自国药集团化学试剂有限公司。中性蛋白酶购于诺维信公司。脱盐柱购于美国 GE 公司。
……….
第三章 大豆蛋白热诱导二硫键连接产物的形成......34
3.1 引言 .........34
3.2 材料与设备....34
3.2.1 材料......34
3.2.2 主要设备..........34
3.3 实验方法 .....34
3.4 结果与讨论 ...........36
3.5 本章小结......47
参考文献 .........48
第四章 生成二硫键聚合体的巯基氧化反应..........51
4.1 引言 .........51
4.2 材料与设备....51
4.2.1 材料......51
4.2.2 主要设备..........51
4.3 实验方法 .....52
4.4 结果与讨论 ...........53
4.5 本章小结......65
参考文献 .........65
第五章 二硫键连接产物的生成对大豆蛋白热诱导聚集的影响 ......68
5.1 引言..........68
5.2 材料与设备 ...........68
5.3 实验方法 .....69
5.4 结果与讨论 ...........71
5.5 本章小结......82
参考文献 .........83
第五章 生成二硫键连接产物对大豆蛋白热诱导聚集的影响
5.1引言
热诱导聚集对大豆蛋白营养和功能性质的影响,例如乳化性、起泡性、凝胶型、体外消化率已经受到广泛研究[1-3]。大豆蛋白的聚集一般被描述成亚基的解离和重组行为:在加热条件下,7S 解离成 α′、α 和 β;11S 解离成它的亚基和亚基的酸性多肽(A)和碱性多肽(B);这些亚基和多肽在分子间相互作用条件下形成聚集体[4,5]。一般认为,聚集体的形成是非共价键(疏水、氢键、静电力)和共价键(二硫键,SS)共同作用的结果[6,7]。但是,哪一种作用是大豆蛋白热聚集的主要驱动力目前还不清楚。β-乳球蛋白的聚集被描述为一种自由基链式反应[8]。巯基(SH)在其中扮演类似自由基的角色。自由基引发,增殖,终止的相对速率最终决定了聚集体的分子量大小[9-11]。然而,对于卵清蛋白,其聚集与 SH 数量无关,非共价键发生于 SS 形成之前[12,13]。到目前为止,关于形成分子间 SS 是否为大豆蛋白热聚集的主要驱动力尚未明确。目前,研究 SS 对热聚集的作用所采取的普遍方法是将修饰或抑制 SS 形成的试剂与蛋白质混合并加热。这些试剂包括 SS 还原剂(如巯基乙醇),SH 封闭试剂(如 NEM)。然而,这些化学试剂对聚集的影响可能不仅仅是干扰 SS 的形成。有研究发现 NEM 能很大程度上减少大豆蛋白凝胶硬度[14],但也有研究指出 NEM 并不能弱化凝胶[7, 15]。某些研究发现低浓度还原剂导致更坚硬的乳清蛋白凝胶[16],但添加更高浓度的还原剂却引起凝胶的弱化[17]。有研究认为化学试剂可能增强蛋白分子的柔性,引起其他形式的相互作用[18]。因此,为了研究 SS 在热聚集中的作用,应除去这些化学试剂。
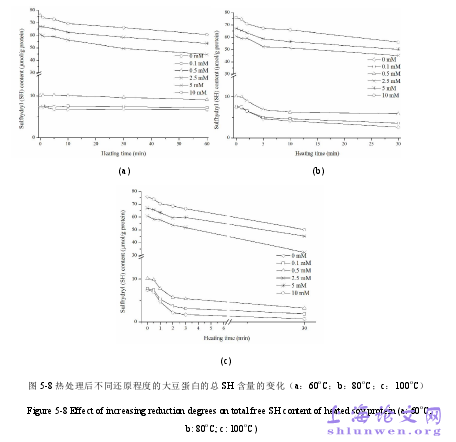
………
结论
1)比较四种试剂(DTNB、DPS、mBBr、NPM)和不同的测定条件(检测体系的 pH、检测试剂和变性剂添加顺序、变性剂浓度、EDTA)对测定未加热和加热 (90°C,5 min)大豆蛋白巯基含量的影响。测定结果与酶解辅助 DPS 法和氨基酸分析法测定的半胱氨酸含量比较以确定最可靠的巯基测定方法。DTNB检测巯基含量时受 pH、变性剂种类、变性剂浓度的影响,其最佳条件:pH 7.0,6 M GuHCl,变性剂于 DTNB 之后与蛋白质混合。但是 DTNB 检测的巯基含量低于半胱氨酸含量,因此 DTNB 不能充分地测定大豆蛋白巯基。DPS 受 pH、变性剂种类、变性剂浓度的影响较小,其最佳条件:pH 7.0,2%SDS 或 4-6 M GuHCl,DPS 先于变性剂与蛋白质混合。其测定结果与半胱氨酸含量一致。EDTA 对于巯基检测没有影响。mBBr 和 NPM 可以在更低的蛋白质浓度(0.3 g/L,是 DTNB和 DPS 所需蛋白质浓度的 1/10)下检测巯基含量,但是测定值高于真实值。#p#分页标题#e#
2)未加热大豆蛋白的二硫键连接物主要是大豆球蛋白亚基(AB),其酸性多肽(A)与碱性多肽(B)通过二硫键连接;其次是 AB 的二聚体和 α'和/或 α 的二聚体。未加热大豆蛋白中 G1 理论上链间 SS(Cys88-Cys298)断裂,并形成新的链间 SS(Cys88-Cys377);G4 除了 A5B3 外还有 SS 连接的 A4B3。加热后大豆蛋白的二硫键连接产物主要是聚合体,其成分是 A、B 及少量 α'、α;其次是A 的单体、B 的二聚体。聚合体主要包括 G1-G4 四种大豆球蛋白亚基。发现 AB的 B 的巯基(G1 的 Cys298、G2 的 Cys289、G4 的 Cys440)在聚合体中转变为二硫键,说明它们可能具有较高的活性,积极参与巯基氧化反应和巯基/二硫键交换反应。
..........
参考文献(略)

